Atomen zijn dus opgebouwd uit protonen, neutronen en elektronen. Die subatomaire deeltjes hebben een kenmerkende massa en lading. De aantallen ervan verschillen van atoom tot atoom.
| Naam |
Locatie |
Symbool |
Aantal |
Relatieve massa* |
Relatieve lading** |
| proton |
kern |
p+ |
Z |
1,007 276 |
1+ |
| neutron |
kern |
n |
A - Z |
1,008 665 |
0 |
| elektron |
mantel |
e- |
Z |
0,000 549 |
1- |
* t.o.v. de atoommassa-eenheid 1,66 10-27 kg
10-27 kg
** t.o.v. de elementaire lading 1,6 10-19 C
10-19 C
Het atoomnummer Z (rangnummer, protonengetal, plaatsnummer) kan afgelezen worden in het periodiek systeem. Het atoomnummer Z geeft het aantal protonen in de kern weer en ook het aantal elektronen in de mantel.
Merk op dat het aantal (negatieve) elektronen in de elektronenwolk gelijk is aan het aantal (positieve) protonen in de kern: atomen hebben namelijk geen lading, het zijn neutrale deeltjes.
De kerndeeltjes (protonen en neutronen) noemt men ook nucleonen. Het nucleonengetal A geeft het aantal nucleonen (protonen + neutronen) weer. Het wordt ook massagetal genoemd.
Het verschil A – Z geeft het aantal neutronen in de kern. Het massagetal A vinden we niet terug in het PS. Het is verschillend voor de verschillende isotope nucliden van het element.
Een nuclide van een bepaald element E wordt als volgt voorgesteld:
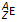
Samengevat
Subatomaire deeltjes |
Een atoom is opgebouwd uit protonen, neutronen en elektronen. |
De positieve protonen en de neutrale neutronen bevinden zich in de kern. Die bevat praktisch de volledige massa.
De negatieve elektronen vinden we terug in de elektronenmantel.
|
| Atomen zijn neutraal: er zitten evenveel protonen in de kern als er elektronen aanwezig zijn in de mantel. |
| Uit het atoomnummer Z en het massagetal A kunnen we de aantallen van ieder deeltjestype berekenen. |