
2. Chemisch evenwicht
Heel wat chemische reacties lijken tot stilstand te komen zelfs voor één of alle uitgangsstoffen opgebruikt zijn.
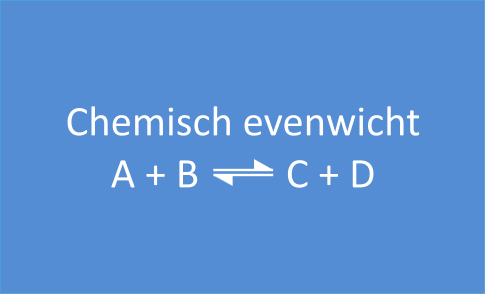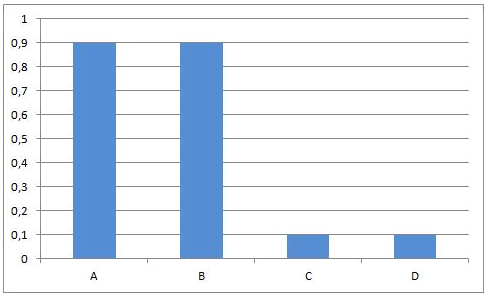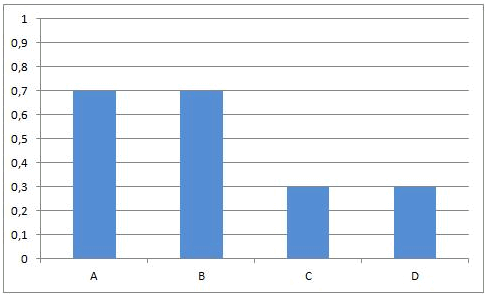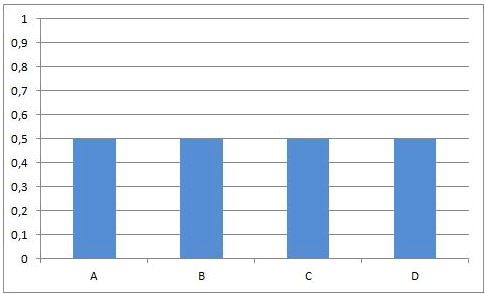
Bovendien leidt in die gevallen het samenvoegen van C en D (in de plaats van A en B) tot dezelfde situatie.
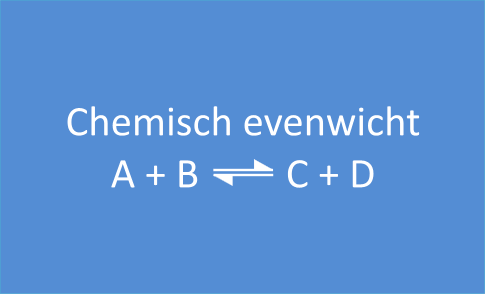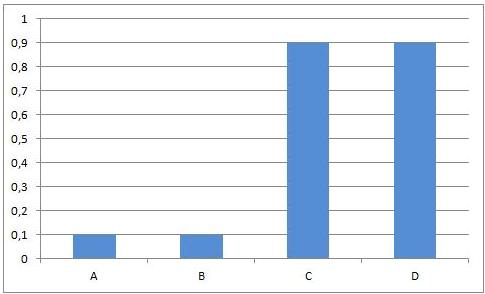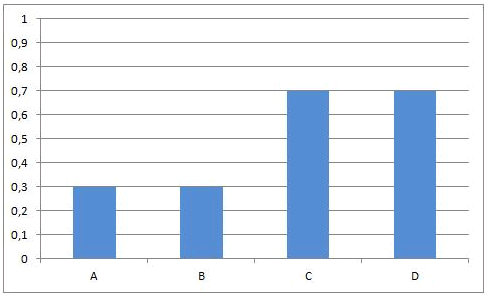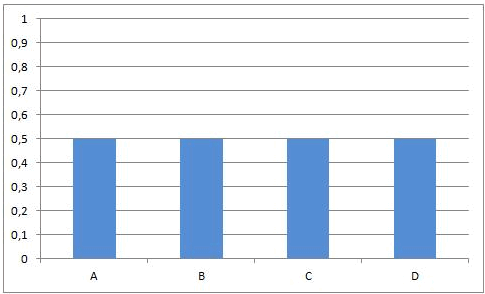
Deze reacties noemen we evenwichtsreacties. Ze worden als volgt voorgesteld, met een dubbele pijl:
A + B 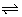 C + D
C + D
De reactie kan in beide richtingen gebeuren:
1 |
voorwaarts (f) |
A + B  C + D C + D |
2 |
omgekeerd (r) |
C + D  A + B A + B |
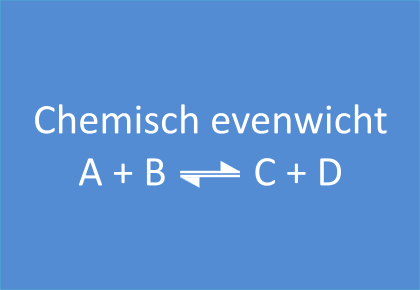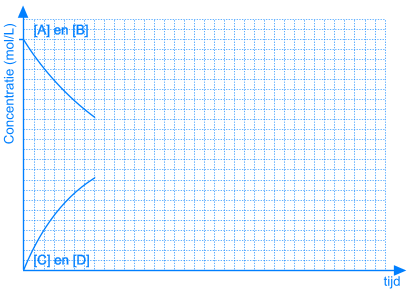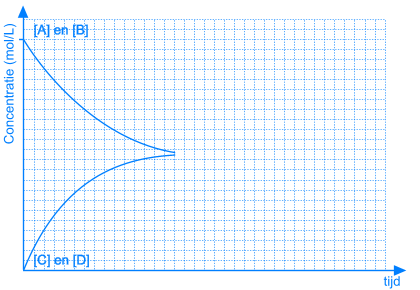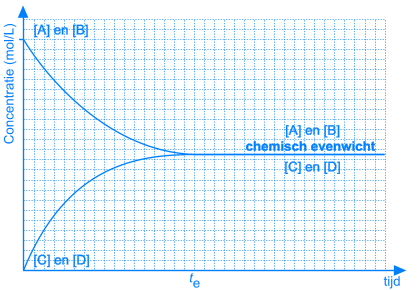
In het begin van deze reactie, als we A en B samenvoegen, zijn de concentraties van A en B maximaal. Op dat ogenblik is de snelheid van de voorwaartse reactie ook maximaal. De reactiesnelheid is immers rechtevenredig met de concentratie(s) van de uitgangsstoffen. Vermits er op dat ogenblik nog geen C en D gevormd is, is de reactiesnelheid van de omgekeerde reactie gelijk aan nul.
Naarmate A en B reageren zullen de concentraties van deze componenten dalen. Ook de snelheid van de voorwaartse reactie zal dus afnemen. Tegelijkertijd ontstaat er meer en meer C en D, waardoor de concentraties van C en D stijgen. Daardoor zal ook de snelheid van de omgekeerde reactie stijgen.
Dit leidt onvermijdelijk tot de situatie dat, op een bepaald ogenblik, de snelheden van de voorwaartse en van de omgekeerde reactie aan elkaar gelijk worden. Vanaf dat ogenblik zullen de concentraties van A, B, C en D constant blijven: chemisch evenwicht.
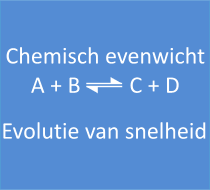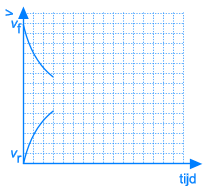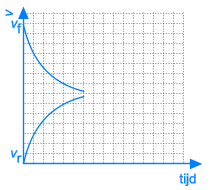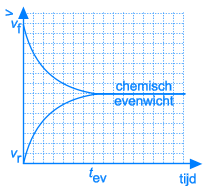
Samengevat
Evenwichtsreacties |
Reacties die schijnbaar tot stilstand komen als nog niet alle uitgangsstoffen opgebruikt zijn. |
De omgekeerde reactie leidt tot dezelfde evenwichtstoestand. |