
8. pH van een oplossing van een zwak zuur
Als het zwakke zuur HOAc (azijnzuur) opgelost wordt in water, zullen slechts enkele HOAc-moleculen een proton afsplitsen:
HOAc(aq) + H2O(vl) 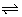 H3O+(aq) + OAc-(aq)
H3O+(aq) + OAc-(aq)
of
HOAc(aq) 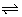 H+(aq) + OAc-(aq)
H+(aq) + OAc-(aq)
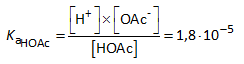
[H3O+] of [H+] en de pH van de oplossing kunnen berekend worden uit Ka.
Voorbeeld: pH van 0,1 mol/L HOAc.
|
HOAc |
H+ |
OAc- |
Begin |
0,1 mol/L |
0 mol/L (*) |
0 mol/L |
D |
- x mol/L |
+ x mol/L |
+ x mol/L |
Evenwicht |
(0,1 - x) mol/L |
x mol/L |
x mol/L |
(*) De waterstofionen afkomstig van de ionisatie van water zijn te verwaarlozen. Het zwakke zuur HOAc (Ka = 1,8 x 10-5) is veel sterker dan het zwakke zuur H2O (Ka = 1,0 x 10-14).

Bij evenwicht vinden we dus: [H+] = 1,3 x 10-3 mol/L  pH = - log 1,3 x 10-3 = 2,88.
pH = - log 1,3 x 10-3 = 2,88.
pH + pOH = 14  pOH = 11,12
pOH = 11,12
Samengevat
pH van een oplossing van een zwak zuur in water
|
Bereken de concentraties bij evenwicht
Bereken hieruit de pH
|