
7. pH van een oplossing van een sterke base
Als de sterke base NaOH in water oplost, zullen bijna alle NaOH-eenheden een proton opnemen:
NaOH(aq) + H2O(vl)  Na+.H2O(aq) + OH-(aq)
Na+.H2O(aq) + OH-(aq)
De [OH-]-concentratie zal dus gelijk zijn aan de oorspronkelijke concentratie van de base NaOH:
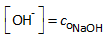
Voorbeeld: 0,1 mol/L NaOH(aq)  [OH-] = 0,1 mol/L
[OH-] = 0,1 mol/L  pOH = -log 0,1 = 1
pOH = -log 0,1 = 1  pH = 13.
pH = 13.
In dit geval is de concentratie van de hydroxide-ionen afkomstig van het water te verwaarlozen naast de 0,1 mol/L afkomstig van de dissociatie van NaOH. In zuiver water is die concentratie slechts 10-7 mol/L. Door de aanwezigheid van een overvloed aan hydroxide-ionen afkomstig van de sterke base NaOH, zal het waterevenwicht helemaal naar links schuiven (Le Chatelier).
Samengevat
pH van een oplossing van een sterke base B in water
|
[OH-] = coB
Bereken hieruit pOH
Bereken hieruit pH
|