
5. Water: zuur of base?
Als een zuur in water opgelost wordt, heeft volgende protolysereactie plaats:
HA(aq) + H2O(vl) 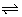 H3O+(aq) + A-(aq)
H3O+(aq) + A-(aq)
In deze reactie gedraagt water zich als een base: water neemt een proton op dat afgesplitst werd door het zuur HA.
Als een base in water opgelost wordt, heeft volgende protolysereactie plaats:
A-(aq) + H2O(vl) 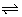 HA(aq) + OH-(aq)
HA(aq) + OH-(aq)
In deze reactie gedraagt water zich als een zuur: water geeft een proton af dat opgenomen wordt door de base A-.
Water kan zich dus gedragen als een zuur (protondonor) en als een base (protonacceptor). Daarom noemen we het een amfolyt.
De auto-ionisatiereactie van water:
H2O(vl) + H2O(vl) 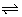 H3O+(aq) + OH-(aq)
H3O+(aq) + OH-(aq)
is dus tegelijk de protolysereactie van het zuur H2O, als de protolysereactie van de base H2O.
De evenwichtsconstante van deze reactie kan dus beschouwd worden als de zuurconstante van water, maar ook als de baseconstante van water:
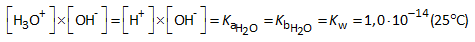
Deze evenwichtsconstanten zijn zeer klein. De evenwichtstoestand ligt dus links. Water is dus slechts theoretisch een zuur/base, in de praktijk beschouwen wij het als een neutrale molecule.
Samengevat
Water is een amfolyt
H2O(vl) + H2O(vl) 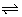 H3O+(aq) + OH-(aq) H3O+(aq) + OH-(aq) |
Water is een zeer zwak zuur
Ka = 10-14 |
Water is een zeer zwakke base
Kb = 10-14 |