
Soren Peter Lauritz Sørensen
Omdat [H+] en [OH-] meestal zeer klein zijn, voerde Sørensen de pH-schaal in.
pH = - log [H+] en pOH = - log [OH-]
[H+] |
pH |
[OH-] |
pOH |
10-7 |
7 |
10-7 |
7 |
10-5 |
5 |
10-9 |
9 |
10-9 |
9 |
10-5 |
5 |
Hetzelfde p-begrip (exponent) wordt gebruikt voor evenwichtsconstanten:
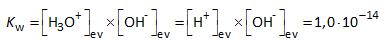
pKw = - log Kw= - log 10-14 = 14
(bij 25°C)
Merk op dat de pH daalt als [H+] toeneemt en vice versa!
Oplossing |
pH |
pOH |
neutraal |
7 |
7 |
zuur |
< 7 |
> 7 |
basisch/alkalisch |
> 7 |
< 7 |
Merk ook op dat in gelijk welke waterige oplossing
pH + pOH = 14
(bij 25°C)