We nemen als voorbeeld de BH3-molecule.
Beschouwen we de elektronenconfiguratie van het B-atoom: 1s2 2s22p1. We zien dat B slechts één normale covalente binding kan vormen. De praktijk geeft echter drie bindingen aan. Om de nodige covalente bindingsmogelijkheden te scheppen, moet er energie aan het B-atoom toegevoegd worden om één 2s-elektron naar één van de lege 2p-orbitalen te brengen. Het B-atoom bevindt zich dan in aangeslagen toestand.
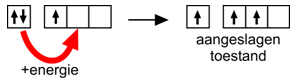
Metingen hebben aangetoond dat de drie B-H-bindingen gelijk zijn in sterkte en in lengte. Een overlapping van een s-orbitale (van H) met respectievelijk een s- en twee p-orbitalen van B kan dit niet verklaren. Men moest drie volkomen gelijkwaardige waarschijnlijkheidsverdelingen in het leven roepen en dat heeft men gedaan door een combinatie te maken van de 2s en de twee half-bezette 2p- orbitalen.
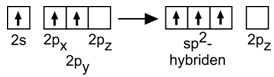
|