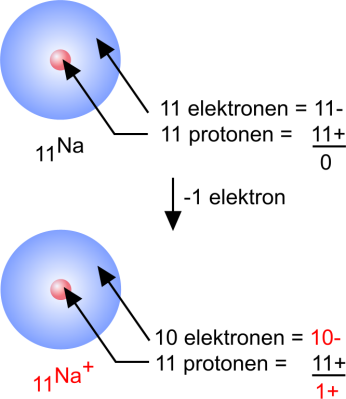
Natrium
11Na: 1s2 2s2 2p6 3s1
Een natriumatoom heeft 1 elektron in de buitenste schil.
Door dit elektron af te geven krijgt het atoom een stabiele edelgasconfiguratie:
Na: 1s2 2s2 2p6 3s1 - 1 e → Na+ : 1s2 2s2 2p6
Het neutrale atoom krijgt daardoor echter een positieve lading. Het wordt een positief ion: natriumion.
|
 |
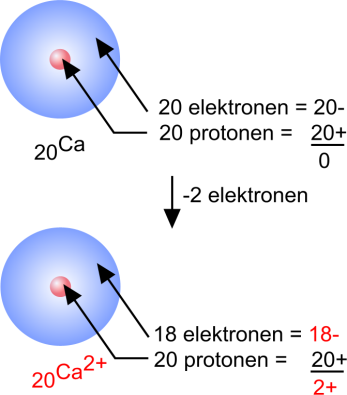
Calcium
20Ca: 1s2 2s2 2p6 3s2 3p6 4s2
Een calciumatoom heeft 2 elektronen in de buitenste schil.
Door die elektronen af te geven krijgt het atoom een stabiele edelgasconfiguratie:
Ca: 1s2 2s2 2p6 3s2 3p6 4s2 − 2 e → Ca2+ : 1s2 2s2 2p6 3s2 3p6
Het neutrale atoom krijgt daardoor echter een tweemaal-positieve lading. Het wordt een tweewaardig positief ion: calciumion. |
 |
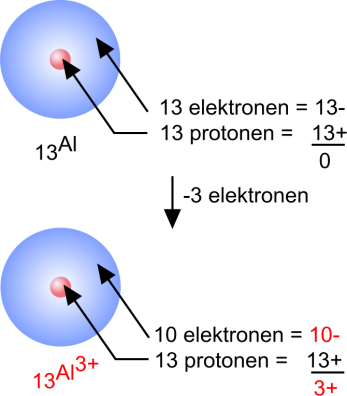
Aluminium
13Al: 1s2 2s2 2p6 3s2 3p1
Een aluminiumatoom heeft 3 elektronen in de buitenste schil.
Door die elektronen af te geven krijgt het atoom een stabiele edelgasconfiguratie:
Al: 1s2 2s2 2p6 3s2 3p1− 3 e → Al3+ : 1s2 2s2 2p6
Het neutrale atoom krijgt daardoor echter een driemaal-positieve lading. Het wordt een driewaardig positief ion: aluminiumion. |
 |
IJzer
26Fe: 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Een ijzeratoom heeft 2 elektronen in de buitenste schil.
Door deze elektronen af te geven krijgt het atoom geen stabiele edelgasconfiguratie:
Fe : 1s2 2s2 2p6 3s2 3p6 3d6 4s2 - 2 e → Fe2+ : 1s2 2s2 2p6 3s2 3p6 3d6 → ijzer(II)ion of ijzer(2+)ion
Nochtans is deze configuratie stabieler dan de originele atoomconfiguratie en Fe2+-ionen worden vaak gevormd.
Maar, zoals vaak het geval is bij metalen uit de overgangsgroepen, ijzeratomen kunnen ook drie elektronen afgeven, waarbij dan Fe3+-ionen ontstaan:
Fe : 1s2 2s2 2p6 3s2 3p6 3d6 4s2 − 3 e → Fe2+ : 1s2 2s2 2p6 3s2 3p6 3d5 → ijzer(III)ion of ijzer(3+)ion
De configuratie van dit ion is zelfs nog stabieler dan die van het Fe2+-ion.
Samengevat
Positieve mono-atomische ionen |
Metalen uit de hoofdgroepen Ia (1), IIa (2) en IIIa (13) bezitten 1, 2 of 3 elektronen in de buitenste schil. Door dit (die) elektron(en) af te geven verkrijgen ze een stabiele edelgasconfiguratie, maar de gewijzigde atomen krijgen daarbij een positieve lading: 1+ , 2+ of 3+. Het worden positieve (+ , 2+ , 3+) ionen of kationen.
|
| Metalen uit de nevengroepen geven soms 1, meestal 2 elektronen af om stabieler te worden. Ze kunnen echter meestal meerdere ionen vormen. De ionen bezitten echter geen edelgasconfiguratie. |