
8. Q versus K
a A(aq) + b B(aq) 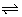 c C(aq) + d D(aq) c C(aq) + d D(aq) |
|
a A(g) + b B(g) 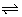 c C(g) + d D(g) c C(g) + d D(g) |
|
Om te weten wat er gebeurt in een mengsel van A en/of B en/of C en/of D, met bepaalde concentraties (in het geval van homogene evenwichten in oplossing) of partieeldrukken (in het geval van homogene gasevenwichten), moeten we Q berekenen.
Er zijn drie mogelijkheden.
In dit uitzonderlijke geval gebeurt er niets bij het mengen van de componenten: bij deze concentraties/partieeldrukken is er evenwicht.
In dit geval is Q te klein (kleiner dan Qev) om een evenwichtstoestand te hebben. Q moet dus groter worden: er moet meer C en D ontstaan en er moet A en B verdwijnen. De voorwaartse reactie treedt op tot er evenwicht is.
a A + b B  c C + d D
c C + d D
In dit geval is Q te groot (groter dan Qev) om een evenwichtstoestand te hebben. Q moet dus kleiner worden: er moet C en D verdwijnen en er moet A en B gevormd worden. De omgekeerde reactie treedt op tot er evenwicht is.
c C + d D  a A + b B
a A + b B
Samengevat
Q |
Reactie |
= Kc of Kp |
geen reactie |
< Kc of Kp |
voorwaartse reactie |
> Kc of Kp |
omgekeerde reactie |