
9. Invloed van uitwendige factoren op de ligging van de evenwichtstoestand
De meeste chemische evenwichten worden verstoord door een wijziging van bepaalde uitwendige omstandigheden. Als gevolg daarvan zullen die evenwichten naar links of naar rechts verschuiven om op die manier een nieuwe evenwichtstoestand te bereiken.
a A + b B 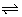 c C + d D c C + d D |
|
|
|
Toevoegen of wegnemen van kleine hoeveelheden uitgangsstoffen of reactieproducten heeft een verandering van Q voor gevolg, waardoor Q niet langer gelijk is aan K: er is geen evenwicht meer.
Als we bijv. een beetje uitgangsstof A toevoegen zal het concentratiequotiënt Q dalen. Om de nieuwe evenwichtstoestand te bereiken zal de reactie doorgaan in die zin waarbij Q opnieuw zal stijgen, tot Q = K. De voorwaartse reactie a A + b B  c C + d D zal plaatshebben. Het evenwicht schuift naar rechts.
c C + d D zal plaatshebben. Het evenwicht schuift naar rechts.
In het omgekeerde geval, door een beetje uitgangsstof A weg te nemen, zal het concentratiequotiënt Q stijgen. Om de nieuwe evenwichtstoestand te bereiken zal de reactie doorgaan in die zin waarbij Q opnieuw zal dalen, tot Q = K.
De omgekeerde reactie c C + d D  a A + b B zal plaatshebben. Het evenwicht schuift naar links.
a A + b B zal plaatshebben. Het evenwicht schuift naar links.
Door toevoegen van een component van een chemisch evenwicht zal het evenwicht verschuiven naar de andere kant dan die waar de component in de reactievergelijking staat.
Door wegnemen van een component van een chemisch evenwicht zal het evenwicht verschuiven naar de kant waar die component in de reactievergelijking staat. |
a A(aq) + b B(aq) 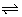 c C(aq) + d D(aq) c C(aq) + d D(aq) |
|
|
Als we bij een homogeen evenwicht in oplossing in een bepaald oplosmiddel extra oplosmiddel toevoegen, dan zullen alle concentraties dalen (verdunning). Als het volume van de oplossing verdubbeld wordt bijvoorbeeld, zullen alle concentraties gehalveerd worden. De verandering van het reactiequotiënt Q hangt dan af van de exponenten van de concentraties.
- (c+d) = (a+b)
In dit geval verandert het reactiequotiënt Q niet. Het evenwicht blijft bestaan.
- (c+d) > (a+b)
In dit geval zal het reactiequotiënt Q dalen. Om een nieuwe evenwichtstoestand te bereiken, zal de reactie doorgaan in die zin waarbij Q opnieuw zal stijgen tot Q = K. De reactie naar rechts zal plaatshebben: a A + b B  c C + d D. Het evenwicht verschuift naar rechts.
c C + d D. Het evenwicht verschuift naar rechts.
- (a+b) > (c+d)
In dit geval zal het reactiequotiënt Q stijgen. Om een nieuwe evenwichtstoestand te bereiken, zal de reactie doorgaan in die zin waarbij Q opnieuw zal dalen tot Q = K. De reactie naar links zal plaatshebben: c C + d D  a A + b B. Het evenwicht verschuift naar links.
a A + b B. Het evenwicht verschuift naar links.
Toevoegen van oplosmiddel (verdunning) aan een homogeen evenwicht in dat oplosmiddel veroorzaakt een verschuiving van het evenwicht naar die kant waar in de reactievergelijking het grootste aantal opgeloste moleculen staat.
Verwijderen van oplosmiddel (door indampen bijv.) uit een homogeen evenwicht in dat oplosmiddel veroorzaakt een verschuiving van het evenwicht naar die kant waar in de reactievergelijking het kleinste aantal opgeloste moleculen staat. |
a A(g) + b B(g) 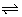 c C(g) + d D(g) c C(g) + d D(g) |
|
|
Door verhogen van de druk op een (homogeen of heterogeen) gasevenwicht neemt het volume af en daardoor nemen alle gasconcentraties toe. Als het volume gehalveerd wordt bijvoorbeeld, verdubbelen alle gasconcentraties. De verandering van het reactiequotiënt Q hangt dan af van de exponenten van de concentraties.
- (c+d) = (a+b)
In dit geval verandert het reactiequotiënt Q niet. Het evenwicht blijft bestaan.
- (c+d) > (a+b)
In dit geval zal het reactiequotiënt Q stijgen. Om een nieuwe evenwichtstoestand te bereiken, zal de reactie doorgaan in die zin waarbij Q opnieuw zal dalen tot Q = K. De reactie naar links zal plaatshebben: c C + d D  a A + b B. Het evenwicht verschuift naar links.
a A + b B. Het evenwicht verschuift naar links.
- (a+b) > (c+d)
In dit geval zal het reactiequotiënt Q dalen. Om een nieuwe evenwichtstoestand te bereiken, zal de reactie doorgaan in die zin waarbij Q opnieuw zal stijgen tot Q = K. De reactie naar rechts zal plaatshebben: a A + b B  c C + d D. Het evenwicht verschuift naar rechts.
c C + d D. Het evenwicht verschuift naar rechts.
Een stijging van de druk op een gasevenwicht veroorzaakt een daling van het volume van het gasmengsel. Daardoor verschuift de evenwichtstoestand naar die kant van de reactie waar het kleinste aantal gasmoleculen aanwezig is.
Een daling van de druk op een homogeen gasevenwicht veroorzaakt een stijging van het volume van het gasmengsel. Daardoor verschuift de evenwichtstoestand naar die kant van de reactie waar het grootste aantal gasmoleculen aanwezig is. |
Veranderingen van concentratie(s), druk en volume hebben voor gevolg dat de ligging van het evenwicht verandert. Aan de evenwichtsconstante verandert er niets.
De verandering van de temperatuur heeft echter wel een verandering van de evenwichtsconstante K voor gevolg.
Voor exotherme evenwichtsreacties zal de evenwichtsconstante K dalen als de temperatuur stijgt. Daardoor zal Qeq dalen: de evenwichtstoestand schuift naar links, in endotherme zin dus.
Voor endotherme evenwichtsreacties zal de evenwichtsconstante K stijgen als de temperatuur stijgt. Daardoor zal Qeq stijgen: de evenwichtstoestand schuift naar rechts, in endotherme zin dus.
Verhoging van de temperatuur doet de ligging van de evenwichtstoestand verschuiven in endotherme zin.
Verlaging van de temperatuur doet de ligging van de evenwichtstoestand verschuiven in exotherme zin. |
Samengevat
Uitwendige verandering |
Evenwichtstoestand |
toevoegen van een component |
verschuiving naar de andere kant |
wegnemen van een component |
verschuiving naar dezelfde kant |
volumetoename |
verschuiving naar de kant met het grootste aantal moleculen |
volume-afname |
verschuiving naar de kant met het kleinste aantal moleculen |
drukstijging |
verschuiving naar de kant met het kleinste aantal gasmoleculen |
drukdaling |
verschuiving naar de kant met het grootste aantal gasmoleculen |
temperatuurstijging |
verschuiving in endotherme zin |
temperatuurdaling |
verschuiving in exotherme zin |