
7. Concentraties en partieeldrukken
Voor chemische evenwichten in oplossing (water als oplosmiddel) schrijven we concentraties (mol/L) in de uitdrukking voor de evenwichtsconstante. Die evenwichtsconstante noemen we Kc. (Zie hieronder de belangrijke opmerking i.v.m. activiteiten)
A(aq) + B(aq) 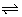 C(aq) C(aq) |
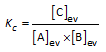 |
Voor chemische evenwichten in de gasfase kunnen we concentraties (mol/L - Kc) of partieeldrukken (bar - Kp) gebruiken in de uitdrukking voor de evenwichtsconstante. (Zie hieronder de belangrijke opmerking i.v.m. activiteiten)
Verband tussen Kc en Kp
a A(g) + b B(g) 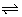 c C(g) + d D(g) c C(g) + d D(g) |
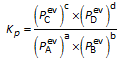 |
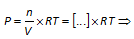
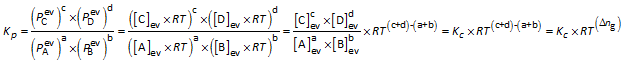
Activiteiten
De concentraties en de partieeldrukken in de evenwichtsconstante zijn in feite activiteiten. Dit heeft voor gevolg dat:
De evenwichtsconstante dimensieloos is. Er worden dus geen eenheden geschreven in een evenwichtsconstante.
In chemische evenwichten in oplossing wordt de concentratie van het oplosmiddel (zelfs indien het aan de reactie deelneemt) niet geschreven in de uitdrukking van de evenwichtsonstante. De activiteit ervan is namelijk gelijk aan 1.
HOAc(aq) + H2O(l) 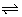 H3O+(aq) + OAc-(aq) H3O+(aq) + OAc-(aq) |
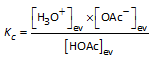 |
In heterogene chemische evenwichten in oplossing komen de concentraties van de onoplosbare componenten niet voor in de uitdrukking van de evenwichtsconstante. De activiteiten ervan zijn gelijk aan 1.
AgCl(s) 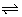 Ag+(aq) + Cl-(aq) Ag+(aq) + Cl-(aq) |
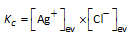 |
In heterogene chemische evenwichten in de gasfase komen de concentraties/partieeldrukken van de niet-gasvormige componenten niet voor in de uitdrukking van de evenwichtsconstante. Ook hiervan zijn de activiteiten gelijk aan 1.