
4. Reactiequotiënt Q
De voortgang of progressie van een chemische reactie kan uitgedrukt worden via het reactiequotiënt Q.
a A + b B 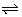 c C + d D
c C + d D
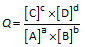
Helemaal bij het begin van de reactie, op het ogenblik dat we A en B samenvoegen, zijn de concentraties van A en B maximaal en de concentraties van C en D zijn dan gelijk aan nul (er is op dat ogenblik nog geen C en D gevormd). Bij het begin van de reactie is het reactiequotiënt dus gelijk aan nul: Q = 0.
Naarmate de reactie vordert zullen de concentraties van A en B dalen en de concentraties van C en D stijgen. Het reactiequotiënt Q zal stijgen.
Als de reactie volledig afgelopen is, zijn de concentraties van A en/of B gelijk aan nul (er is geen A en/of B meer over) en dan zijn de concentraties van C en/of D maximaal. Als de reactie volledig afgelopen is, is het reactiequotiënt oneindig groot.
Het reactiequotiënt Q is dus een getal (tussen 0 en oneindig) dat uitdrukt in hoeverre een chemische reactie gevorderd is. Als voor een bepaalde reactie Q = 0, dan is de reactie nog niet gestart. Als voor die reactie Q oneindig groot is, is de reactie afgelopen.
Een evenwichtsreactie gaat door tot Q een zekere waarde bereikt, typisch voor de reactie. Van zodra Q deze waarde bereikt, lijkt de reactie tot stilstand te komen: de concentraties van alle reactiecomponenten (uitgangsstoffen en reactieproducten) blijven constant. Deze toestand noemen we de evenwichtstoestand.
Samengevat
Reactiequotiënt Q |
Geeft de progressie van een chemische reactie weer. |
Een waarde tussen 0 (geen reactie) en oneindig (reactie volledig afgelopen) |