
5. Evenwichtsconstante K
De progressie van een chemische reactie wordt uitgedrukt door het reactiequotiënt Q.
a A + b B 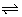 c C + d D
c C + d D
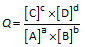
Een evenwichtsreactie gaat door tot Q een bepaalde waarde bereikt (typisch voor die reactie). Die waarde noemen we de evenwichtsconstante K van de reactie.
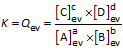
Als de evenwichtsconstante K van een evenwichtsreactie klein is, dan ligt de evenwichtstoestand links. In deze evenwichtstoestand is er nog veel van de uitgangsstoffen A en B aanwezig, terwijl er slechts kleine hoeveelheden C en D aanwezig zijn. Als K zeer klein is (bijna nul) gaat de reactie niet door (de evenwichtsconcentraties van A en B zijn praktisch gelijk aan de beginconcentraties, de evenwichtsconcentraties van C en D zijn praktisch gelijk aan nul).

Als de evenwichtsconstante K van een evenwichtsreactie groot is, dan ligt de evenwichtstoestand rechts. In deze evenwichtstoestand zijn er slechts kleine hoeveelheden van de uitgangsstoffen A en/of B aanwezig, terwijl er grote hoeveelheden C en D aanwezig zijn. Als K zeer groot is (bijna oneindig) is de reactie quasi aflopend (de evenwichtsconcentraties van A en/of B zijn praktisch gelijk nul, de evenwichtsconcentraties van C en D zijn maximaal).

Samengevat
K |
Voorbeelden |
Ligging van de evenwichtstoestand |
zeer klein |
K < 10-30 |
volledig links, reactie gaat niet door |
klein |
10-30 < K < 10-3 |
links |
|
10-3 < K < 103 |
ergens in het midden, echt evenwicht |
groot |
103 < K < 1030 |
rechts |
zeer groot |
K > 1030 |
volledig rechts, aflopende reactie |