Veel ionverbindingen zijn goed oplosbaar in water. Bovendien geleiden die oplossingen een elektrische stroom. Dat kunnen we als volgt verklaren.
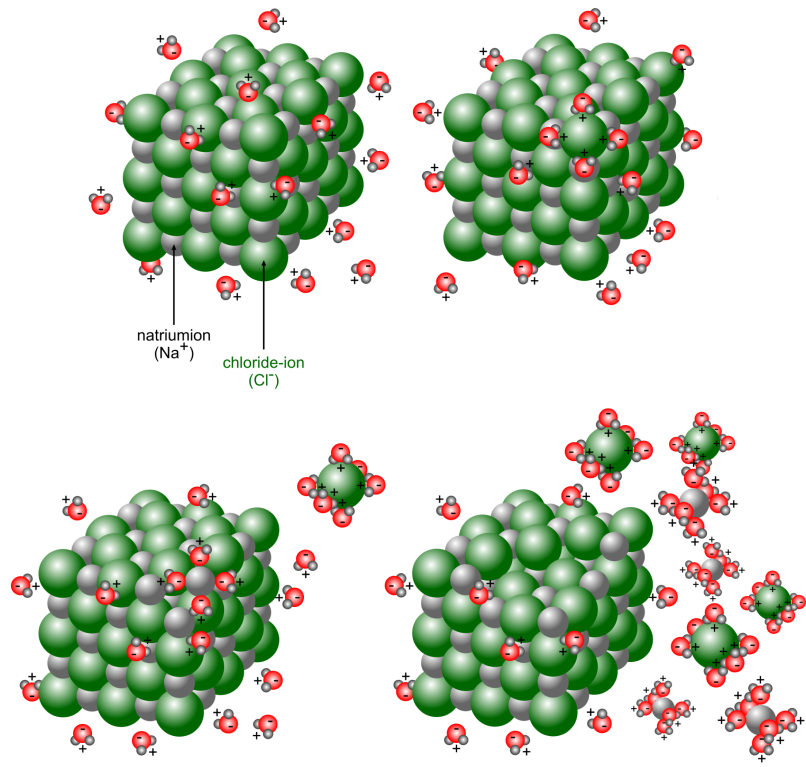
Ionverbindingen zijn opgebouwd uit ionen die elkaar sterk aantrekken en in een ionrooster vastzitten. Bij contact met water (polair oplosmiddel) trekken de positieve metaalionen in het rooster de negatieve polen van de watermoleculen aan. Daardoor wordt elk positief ion in het rooster omringd door watermoleculen. De negatieve niet-metaalionen in het rooster trekken de positieve polen van de watermoleculen aan, waardoor ook zij omringd worden door watermoleculen. Daardoor worden de afstanden tussen de ionen in het rooster groter en dus de aantrekkingskrachten tussen die ionen kleiner (in water ongeveer 80 keer kleiner). De ionen worden met watermoleculen omringd (= hydratatie) en komen uit het rooster los: het zout lost op. Door de aanwezigheid van vrij beweeglijke (geladen) ionen geleidt de oplossing een elektrische stroom.
NaCl(aq) + 12 H2O 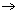 Na+(H2O)6(aq) + Cl-(H2O)6(aq)
Na+(H2O)6(aq) + Cl-(H2O)6(aq)
Of eenvoudiger
NaCl(aq) 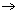 Na+(aq) + Cl−(aq)
Na+(aq) + Cl−(aq)
Dit noemen we een dissociatie: dit is het vrijkomen van ionen uit het ionrooster.
Samengevat
Dissociatie van ionverbindingen |
Veel ionverbindingen lossen goed op in polaire oplosmiddelen.
Daarbij komen de ionen uit het rooster vrij: dissociatie van de ionverbinding.
Door het feit dat er daarbij ionen vrijkomen, geleidt de oplossing de stroom.
Dergelijke stoffen noemen we daarom ook elektrolyten.
Soms zijn de aantrekkingskrachten tussen de ionen in het rooster te sterk en lost de ionverbinding bijna niet op.
|