
9. Polaire covalente binding - Elektronegativiteit
Wij mogen nooit uit het oog verliezen dat wij niet in staat zijn een atoombril op te zetten waarmee atomen in hun gebonden toestand kunnen geobserveerd worden, verre van iets te kunnen zien i.v.m. hun elektronenomringing. Wat wij op papier zetten als voorstellingswijzen zijn niet noodzakelijk exacte weergaven van de realiteit, maar onze modellen hebben waarde vanaf het ogenblik dat wij met die modellen in staat zijn waargenomen eigenschappen te verklaren en te voorspellen. Niet anders is het met de lewisvoorstelling van moleculen en ionen.
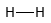
Dit is de perfecte, 100% covalente binding, waarbij de verdeling van het bindende elektronenpaar homogeen over beide kernen gebeurt. Met andere woorden: het bindende elektronenpaar brengt evenveel tijd door rond beide H-kernen: het bindende elektronenpaar is homogeen verdeeld over beide kernen.
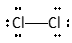
Dit is ook het geval in een molecule dichloor.
We hebben in beide gevallen te maken met een apolaire covalente binding.
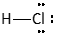
Als het gemeenschappelijke elektronenpaar zich bevindt tussen twee verschillende atoomkernen, dan wordt het door beide kernen (meestal) niet even sterk aangetrokken.
Drie aspecten hebben hier een invloed.
1. De grootte van de kernladingen
De H-kern bevat slechts 1 proton, de Cl-kern daarentegen bevat er 17 en is dus veel positiever dan de H-kern. Hieruit zouden we (voorbarig) kunnen besluiten dat de chloorkern 17 keer sterker het gemeenschappelijke elektronenpaar aantrekt.
2. De afstand tussen de kernen en het gemeenschappelijke elektronenpaar
De binding gebeurt met een elektron uit de 1ste schil van H en een elektron uit de 3de schil van Cl. Het bindende paar zit dus dichter bij de H-kern dan bij de Cl-kern. Hieruit zouden we (voorbarig) kunnen besluiten dat de H-kern sterker aan het elektronenpaar trekt.
3. Afscherming van de kern
Tussen de Cl-kern en het bindende elektronenpaar bewegen er nog 16 andere elektronen. Daardoor wordt de positieve Cl-kern afgeschermd en oefent hij een kleinere aantrekking uit op het bindingspaar.
Het resultaat van al deze factoren is dat het bindende elektronenpaar in dit geval het sterkst wordt aangetrokken door de Cl-kern. Hierdoor, zeggen we, verschuift het bindende paar naar Cl toe. In feite betekent dit dat het bindende paar meer tijd rond de Cl-kern doorbrengt dan rond de H-kern.
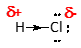
De elektronendichtheid rond de Cl-kern wordt groter dan in ongebonden toestand: het Cl-atoom wordt een beetje negatief, terwijl het in zijn ongebonden toestand neutraal is. Het Cl-atoom krijgt een negatieve deellading gesymboliseerd door de Griekse letter d (= d van deellading), gevolgd door een teken.
De elektronendichtheid rond de H-kern wordt kleiner dan in ongebonden toestand: het H-atoom wordt een beetje positief, terwijl het in zijn ongebonden toestand ook neutraal is.
De verschuiving van het bindende paar wordt aangegeven door een pijl in het midden van het bindingsstreepje.
Bij een asymmetrische verdeling van het bindende paar spreken we van een polaire covalente binding.
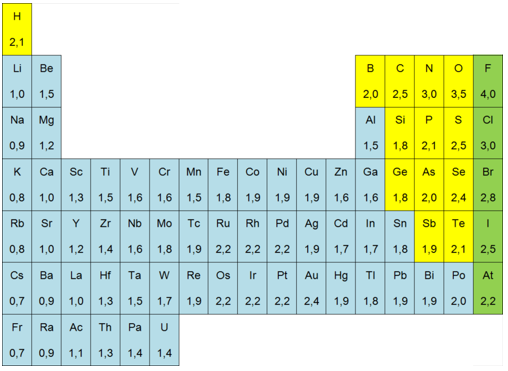
Elektronegativiteit c
De elektronegativiteit of elektronegatieve waarde c van een element is een onbenoemd getal, dat uitdrukt in welke mate het atoom bij een covalente binding het gemeenschappelijke elektronenpaar naar zich toetrekt.
Samengevat
Polaire covalente binding - Elektronegativiteit |
Bij een asymmetrische verdeling van het bindende elektronenpaar spreken we van een polaire covalente binding.
De elektronegativiteit of elektronegatieve waarde c van een element is een onbenoemd getal, dat uitdrukt in welke mate het atoom bij een covalente binding het gemeenschappelijke elektronenpaar naar zich toetrekt.
|