
10. s- en p-bindingen
| Er wordt verondersteld dat, als twee atomen zich met elkaar binden, de orbitalen waarin de ongepaarde elektronen zich bevinden, elkaar overlappen. Op die manier kan in de overlappingsruimte een gemeenschappelijk elektronenpaar ontstaan. |
|
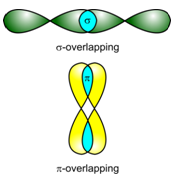
Men spreekt van een s-overlapping of een s-binding als de symmetrieassen van de overlappende orbitalen in elkaars verlengde liggen.
De bindende elektronen (het bindende doublet) worden aangebracht in de overlappingsruimte. De elektronen moeten een tegengestelde spin hebben omdat ze tot éénzelfde orbitaal moeten kunnen behoren. Bij deze bindingsbenadering is de sterkte van de binding evenredig met de grootte van de overlappingsruimte.
Andere voorbeelden
Difluor F2
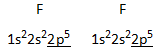
|
|
Waterstoffluoride HF
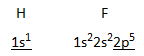
|
|
In heel wat moleculen komen er dubbele en/of drievoudige bindingen voor: er zijn twee of drie gemeenschappelijke elektronenparen tussen twee atomen. In die gevallen moet er dan ook twee of drie keer overlapping tussen orbitalen optreden. Dit is o.a. het geval bij dizuurstof.
Voorbeelden
Dizuurstof O2
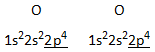
De px-orbitalen overlappen elkaar rechtstreeks: er ontstaat een s–binding. De pz-orbitalen overlappen elkaar zijdelings (alhoewel dit op de figuur, voor de leesbaarheid, niet zo is). In dit geval spreekt men van een p–overlapping of p–binding: de symmetrie-assen van de overlappende orbitalen lopen evenwijdig, maar vallen niet samen.
|
|
Men spreekt van een p-overlapping of een p-binding als de symmetrieassen van de overlappende orbitalen parallel lopen (zijdelingse overlapping).
Distikstof N2
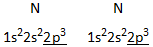
Naast de s–binding (rechtstreekse overlapping tussen de px-orbitalen) zijn er nu twee p–bindingen (zijdelingse overlapping tussen respectievelijk de py-orbitalen en de pz-orbitalen).

|
|
Samengevat
s- en p-bindingen |
Bij een s-overlapping of een s-binding liggen de symmetrieassen van de overlappende orbitalen in elkaars verlengde.
Bij een p-overlapping of een p-binding lopen de symmetrieassen van de overlappende orbitalen parallel (zijdelingse overlapping).
Een s-binding is sterker dan een p-binding, omdat de overlappingsruimte bij een s-overlapping groter is dan bij een p-overlapping.
|