
8. Tekenen van lewisstructuren
Voor de opbouw van complexere moleculen kan men ook beroep doen op enkele regels die steunen op de edelgasconfiguratie. We bespreken deze regels aan de hand van enkele voorbeelden.
Voorbeeld 1: H3PO4
1ste stap
We bepalen de som van alle valentie-elektronen, eventueel vermeerderd met het aantal negatieve ladingen bij een negatief polyatomisch ion of verminderd met het aantal positieve ladingen bij een positief polyatomisch ion.
Dit getal noemen we V.
V = 3 x 1 (H) + 1 x 5 (P) + 4 x 6 (O) = 32
2de stap
We berekenen het aantal elektronen nodig om aan ieder atoom de gepaste edelgasconfiguratie te geven.
Dit getal noemen we E.
E = 3 x 2 (H) + 1 x 8 (P) + 4 x 8 (O) = 46
3de stap
Vermits er 46 elektronen nodig zijn om voor edelgasconfiguraties te zorgen (E) en we slechts over 32 elektronen (V) beschikken, zullen er elektronen tweemaal moeten geteld worden. Enkel de bindende paren worden dubbel geteld.
Uit het voorgaande cijfermateriaal kunnen we berekenen dat er 14 (= E - V) elektronen dubbel moeten geteld worden wat overeenkomt met 7 bindende paren.
4de stap
We tekenen de structuur zo symmetrisch mogelijk en brengen de bindende paren aan. Hierbij letten we er op dat waterstof steeds eindstandig is, dat bij oxozuren (zoals H3PO4) de zuurstofatomen gebonden zijn aan het centrale atoom.
5de stap
We berekenen het aantal niet-bindende of vrije elektronenparen. Hiervoor nemen we het aantal aanwezige valentie-elektronen ( = V) en trekken daarvan het aantal bindende elektronen af. Om het aantal paren te bekomen delen we door twee. We brengen een aantal niet-bindende elektronenparen rond ieder atoom aan. Hierbij houden we rekening met de twee- (He) of achtomringing.
(32 - 14) / 2 = 9
6de stap
We brengen de formele ladingen aan.
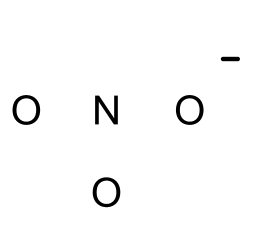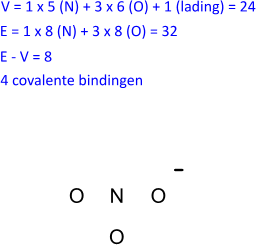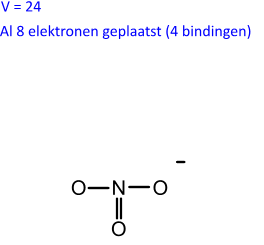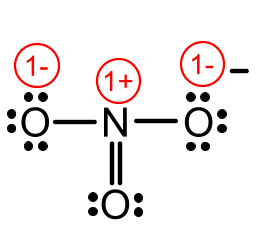
Wanneer in een lewisformule een covalent gebonden atoom in zijn onmiddellijke omgeving meer of minder valentie-elektronen heeft dan in ongebonden toestand, draagt het atoom een negatieve of positieve formele lading.
Voor de bepaling van het aantal elektronen rond het gebonden atoom rekent men niet-bindende paren tot het atoom waarbij ze staan. Van de bindende paren krijgt iedere bindingspartner één elektron toegewezen. De aldus bekomen som wordt vergeleken met het normale aantal valentie-elektronen om de formele lading te bepalen.
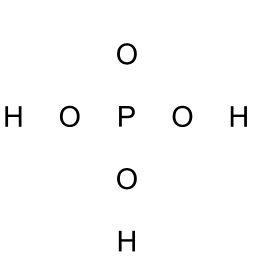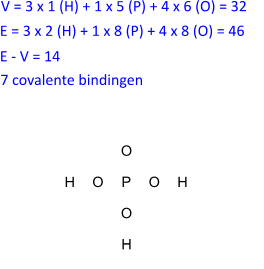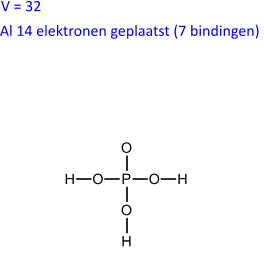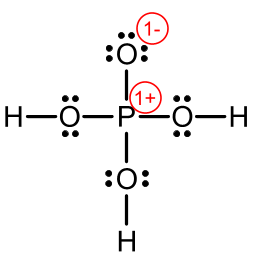
De formele lading speelt een belangrijke rol bij heel wat begrippen: zuursterkte, organische reactiemechanismen, …
Voorbeeld 2: NO3-
1ste stap
V = 1 x 5 (N) + 3 x 6 (O) + 1 (lading) = 24
2de stap
E = 1 x 8 (N) + 3 x 8 (O) = 32
3de stap
E − V = 8 elektronen moeten dubbel geteld worden wat overeenkomt met 4 bindende paren.
4de stap
We tekenen de structuur zo symmetrisch mogelijk en brengen de bindende paren aan. Drie enkelvoudige bindingen volstaan dus niet. Eén binding wordt een dubbele binding.
5de stap
We berekenen het aantal niet-bindende of vrije elektronenparen. Hiervoor nemen we het aantal aanwezige valentie-elektronen ( = V) en trekken daarvan het aantal bindende elektronen af. Om het aantal paren te bekomen delen we door twee. We brengen een aantal niet-bindende elektronenparen rond ieder atoom aan. Hierbij houden we rekening met de twee- (He) of achtomringing.
(24 - 8) / 2 = 8
6de stap
We brengen de formele ladingen aan.
In een lewisstructuur hebben de atomen meestal een octetomringing (uitz. H). Dit is echter niet altijd het geval. In die gevallen gaan we anders tewerk.
Voorbeeld 3: BCl3
Schrijf de elektronenconfiguratie van B en Cl en stel de valentie-elektronen voor:

Het B-atoom bevat in deze toestand slechts één ongepaard elektron en kan dus slechts één covalente binding vormen. Het B-atoom kan echter wel 3 bindingen vormen in geëxciteerde toestand:

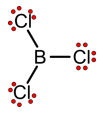
Het B-atoom verkrijgt echter geen octetstructuur: het heeft maar 6 elektronen rond zich.
Alle atomen hebben het normale aantal elektronen rond zich (B: 3 ; Cl: 7). Er zijn geen formele ladingen.
Voorbeeld 4: SF6
Schrijf de elektronenconfiguratie van S en F en stel de valentie-elektronen voor:
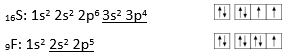
Het S-atoom bevat in deze toestand slechts twee ongepaarde elektronen en kan dus slechts twee covalente bindingen vormen. Het S-atoom kan echter wel 6 bindingen vormen in geëxciteerde toestand:

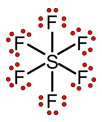
Het S-atoom verkrijgt echter geen octetstructuur: het heeft zelfs 12 elektronen rond zich.
Alle atomen hebben het normale aantal elektronen rond zich (S: 6 ; F: 7). Er zijn geen formele ladingen.
Samengevat
Tekenen van lewisstructuren |
De lewisstructuur kan meestal in enkele stappen afgeleid worden.
Bepaal het totaal aantal valentie-elektronen V (let op voor geladen deeltjes) en het aantal elektronen E dat nodig is om elke atoom een edelgasconfiguratie te bezorgen.
Het verschil tussen beide waarden (gedeeld door 2) levert het aantal bindingen op.
Neem het aantal aanwezige valentie-elektronen ( = V) en trekken daarvan het aantal bindende elektronen af. Dan vind je het aantal vrije elektronen. Om het aantal vrije elektronenparen te bekomen delen je door twee.
Breng dit aantal niet-bindende elektronenparen rond ieder atoom aan. Hierbij houd je rekening met de twee- (He) of achtomringing.
Bepaal de formele lading van elk atoom.
|