Volgens het atoommodel van Bohr bewegen de elektronen met grote snelheden rond de kern. Bovendien hebben die elektronen bepaalde energieŽn. Met andere woorden, zij zijn verdeeld over een aantal schillen of hoofdenergieniveaus volgens welbepaalde regels.
Er zijn 7 hoofdenergieniveaus of schillen (K, L, M, ..., Q) die genummerd worden van 1 tot 7. Dit nummer wordt het hoofdkwantumgetal n genoemd.
Hoofdkwantumgetal n
n = 1 , 2 , 3 , Ö , 7
Het hoofdkwantumgetal n zegt iets over de afstand tussen de kern en het elektron.
Deze hoofdniveaus, uitgezonderd het eerste, bevatten een aantal subniveaus waarvan de energieŽn lichtjes verschillen.
Het nummer van het subniveau wordt het nevenkwantumgetal l genoemd en dat kan alle gehele waarden tussen 0 en (n -1) hebben.
Nevenkwantumgetal l
l = 0 , 1 , 2 , … , (n-1)
In onderstaand schema vind je een overzicht van de verschillende hoofd- en subniveaus: |

Subniveaus |
| Hoofdkwantumgetal n |
Hoofdniveau |
Aantal subniveaus |
Naam |
Nevenkwantumgetal l |
| 1 |
K |
1 |
1s |
0 |
| 2 |
L |
2 |
2s
2p
|
0
1
|
| 3 |
M |
3 |
3s
3p
3d
|
0
1
2
|
| 4 |
N |
4 |
4s
4p
4d
4f
|
0
1
2
3
|
| 5 |
O |
(5*) |
5s
5p
5d
5f
|
0
1
2
3
|
| 6 |
P |
(6*) |
6s
6p
6d
6f
|
0
1
2
3
|
| 7 |
Q |
(7*) |
7s
7p
7d
7f
|
0
1
2
3
|
* Subniveaus met nevenkwantumgetallen 4 , 5 en 6 zal je nooit ontmoeten.
Uit spectroscopisch onderzoek blijkt verder dat in elk subniveau de elektronen een bepaald aantal banen ter beschikking hebben. Dit aantal hangt af van het nevenkwantumgetal van het subniveau en de banen worden genummerd van -l tot +l. Dit nummer noemt men het magnetisch kwantumgetal ml.
Magnetisch kwantumgetal ml
ml = -l , Ö , 0 , Ö , +l
| Subniveau |
Aantal banen |
ml |
| s |
1 |
|
| p |
3 |
|
| d |
5 |
|
| f |
7 |
|
Uit de doubletstructuur van de spectraallijnen leidt men af dat in elke baan maximaal twee elektronen kunnen bewegen. Die twee elektronen voeren een tegengestelde spinbeweging uit en krijgen een nummer (+ Ĺ of - Ĺ) dat men het spinkwantumgetal ms noemt.
Spinkwantumgetal ms
ms = + Ĺ of - Ĺ
| Door die tollende bewegingen rond hun eigen as ontstaan namelijk zeer zwakke magneetveldjes die tegengesteld gericht zijn.
De pijltjes geven aan hoe een kurkentrekker zich verplaatst als de handgreep draait in dezelfde zin als het elektron. Tegengestelde pijltjes (tegengestelde magneetveldjes) trekken elkaar aan en daardoor stoten die elektronen (met tegengestelde spin) elkaar minder af.
Die pijltjes worden later ook gebruikt om elektronen voor te stellen. |
|
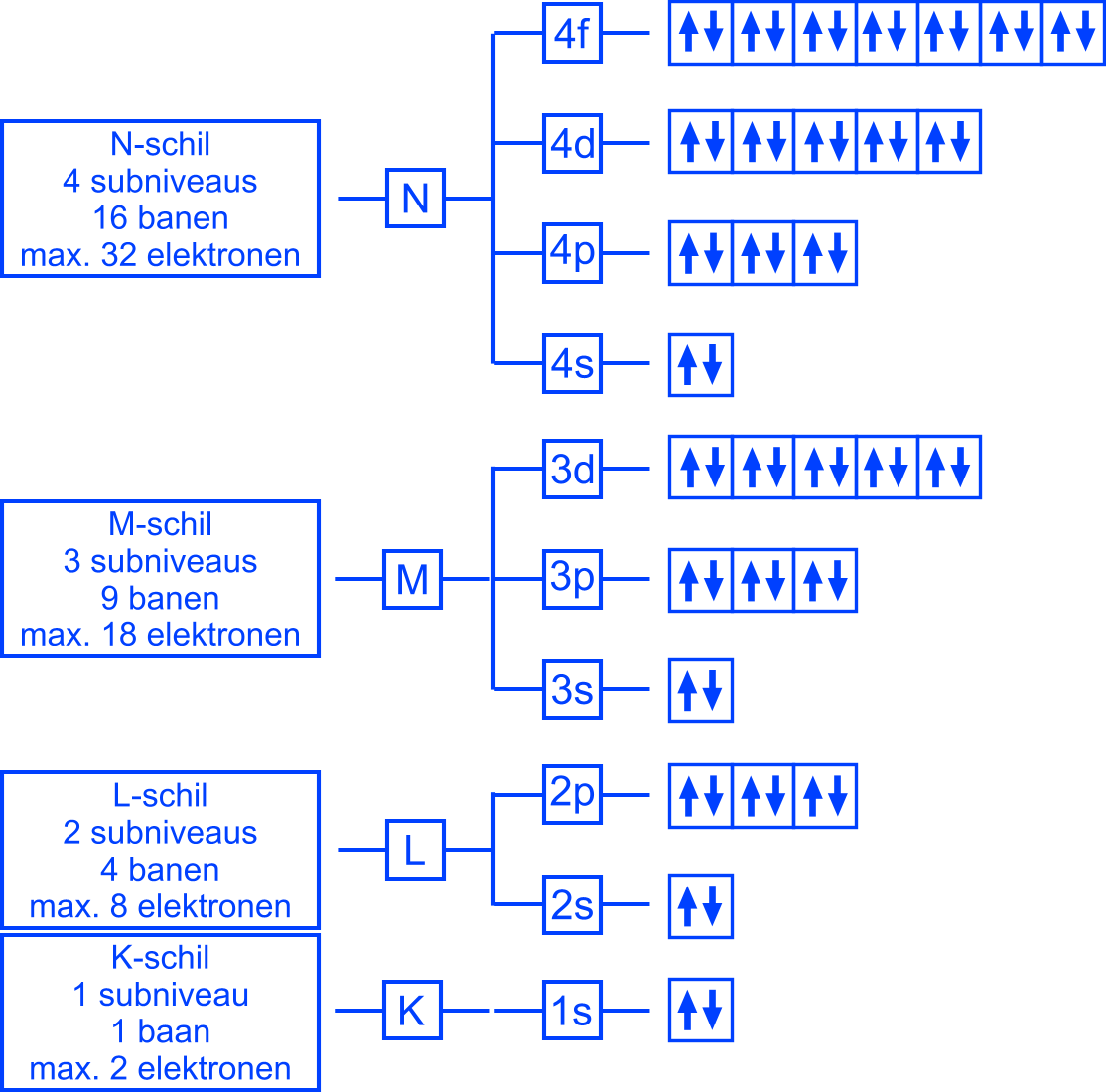
Samengevat
Kwantummechanisch atoommodel |
De elektronen zijn verdeeld over een aantal hoofdenergieniveaus die in energie verschillen (schillen): K, L , M , N , ...
|
| In elk hoofdenergieniveau zijn er een aantal subniveaus die in energie verschillen: s , p , d , f. |
| In elk subniveau zijn er een aantal banen. |
| In elke baan kunnen maximaal twee elektronen. |