Het zijn de elektronen, of beter, de elektronenverdelingen van de buitenste schil die de chemische eigenschappen van een atoom bepalen.
Onder buitenste schil verstaan we de verzameling van subniveaus met hoogste hoofdkwantumgetal.
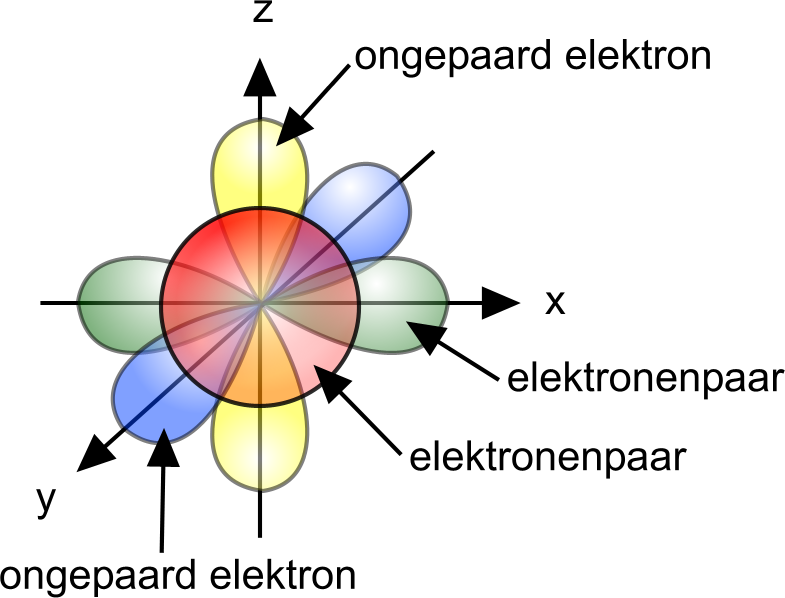
De aantrefkans van de elektronen rond de kern kunnen we met een bepaalde vorm voorstellen. Deze vormen verschillen in afmetingen naargelang de waarde van n.
s-orbitalen hebben een bolvorm, p-orbitalen hebben de vorm van een halter of zandloper.
Hoe groter het hoofdkwantumgetal n, hoe uitgestrekter de orbitale.
Op die manier krijgen de atomen een ruimtevormelijk karakter en krijgen we meer inzicht omtrent de ruimtelijke structuren van atomen en moleculen.
Voorbeeld
34Se: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4

|