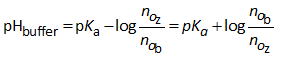15. Buffers
In bovenstaande animatie worden de formules HAc, NaAc en Ac- gebruikt. Gelieve die te lezen als HOAc, NaOAc en OAc-.
Bij een oplossing van HOAc en NaOAc in water kunnen we een beperkte hoeveelheid sterke base, sterk zuur of water toevoegen zonder dat de pH noemenswaardig verandert. Dergelijke mengsels noemen we buffers.
Verklaring
Bij het oplossen van HOAc in zuiver water (pH = 7) daalt de pH. Dit is logisch, want HOAc is tenslotte een zwak zuur. Onderstaand evenwicht ligt dus links.
HOAc(aq) 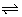 H+(aq) + OAc-(aq)
H+(aq) + OAc-(aq)
Het toevoegen van NaOAc doet de pH lichtjes stijgen.
Het toegevoegde zout splitst namelijk volledig in ionen:
NaOAc  Na+ + OAc-
Na+ + OAc-
Door toevoegen van OAc--ionen schuift het bovenstaande evenwicht nog meer naar links, waardoor de concentratie van H+ daalt en de pH stijgt.
Het mengsel bevat nu, naast water, volgende deeltjes:
veel HOAc, praktisch evenveel als we hebben toegevoegd
veel OAc−, praktisch evenveel als we hebben toegevoegd
veel Na+, evenveel als we hebben toegevoegd, maar die ionen spelen verder geen rol.
Toevoegen van een sterk zuur (H+) doet de pH nauwelijks veranderen, omdat praktisch alle toegevoegde protonen met de aanwezig OAc−-ionen combineren tot HOAc.
Toevoegen van een sterke base (OH-) doet de pH nauwelijks veranderen, omdat praktisch alle toegevoegde hydroxide-ionen met aanwezige HOAc-moleculen reageren (OH- + HOAc  H2O + OAc−).
H2O + OAc−).
Er zijn natuurlijk grenzen: elke buffer heeft een beperkte buffercapaciteit. Die wordt bepaald door de hoeveelheid zuur HOAc en zout NaOAc dat aanwezig is.
Een buffer is een mengsel van een zwak zuur en zijn geconjugeerde base of van een zwakke base en zijn geconjugeerde zuur.
Binnen bepaalde grenzen verandert de pH van een buffer niet noemenswaardig, zelfs niet bij toevoegen van een sterk zuur of een sterke base.
De pH van een buffer kan als volgt berekend worden.
Beschouw volgende buffer, bestaande uit een mengsel van een zwak zuur HX en zijn geconjugeerde base X-, aanwezig onder de vorm van een zout:
HX 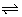 H+ + X-
H+ + X-
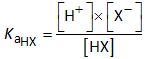
NaX  Na+ + X-
Na+ + X-
Vermits HX een zwak zuur is kunnen we schrijven, zeker in aanwezigheid van X-:
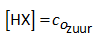
Vermits NaX volledig in ionen splitst kunnen we schrijven:
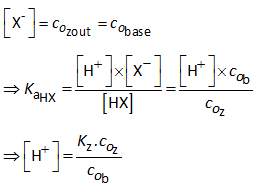
Dus:
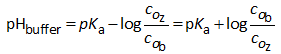
Daar in deze formule een verhouding van concentraties voorkomt, speelt het volume dus geen enkele rol. Ook bij verdunnen met water verandert de pH van een buffer niet. We kunnen bovenstaande formule dus ook als volgt schrijven: