10 mL NH3-oplossing met concentratie 1,228 mol/L wordt in een maatkolf van 500,0 mL gebracht. De maatkolf wordt verder opgevuld met water.

Bereken de pH van deze oplossing?
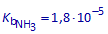
Hoeveel mol NH3 is er aanwezig in 10 mL NH3-oplossing met concentratie 1,228 mol/L?
Hoe groot is de concentratie ervan na verdunnen?
NH3 is een zwakke base.
NH3 ioniseert slechts weinig.
Schrijf de protolysereactie ervan.
Maak (in tabelvorm) een overzicht van de concentraties (begin , D , evenwicht).
Substitueer de evenwichtsconcentraties in de uitdrukking voor Kb en leid daaruit de vierkantsvergelijking voor x af.
Bereken nu de concentraties bij evenwicht.
