|


7. Stofhoeveelheid
Een hoeveelheid stof kan je op verschillende manieren uitdrukken.
Massa van de stof m(X) (Eenheden: g , kg , mg)
63,5 g Cu
196,2 g H2SO4
9,0 g H2O |
De massa kan in verschillende eenheden uitgedrukt worden (mg ,g ,kg ,
ton, …).
In de chemie wordt een massa vaak uitgedrukt in gram.
De massa kan gemeten worden met een balans. |
Stofhoeveelheid n(X) (Eenheid: mol)
1 mol Cu
2 mol H2SO4
0,5 mol H2O |
Bij chemische reacties reageren de deeltjes volgens bepaalde verhoudingen met elkaar. Met de mol beschikken we over een eenheid, die met een welbepaald aantal deeltjes overeenstemt. Het speelt daarbij helemaal geen rol of die deeltjes groot zijn of klein, een grote of een kleine massa hebben.
De hoeveelheid van een stof n(X) kan niet rechtstreeks gemeten worden: ze moet worden berekend. Daarvoor gebruiken we volgende formule:
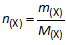 |
Aantal deeltjes van de stof N(X) (Eenheid: onbenoemd)
6,0 1023 atomen Cu 1023 atomen Cu
1,2 1024 moleculen H2SO4 1024 moleculen H2SO4
3,0 1023 moleculen H2O 1023 moleculen H2O |
Vaak is het nuttig te weten hoeveel deeltjes in een bepaalde hoeveelheid stof aanwezig zijn. Dit aantal wordt voorgesteld met N(X).
Ook deze grootheid moet berekend worden:
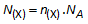
NA = constante van Avogadro = 6,0 1023 /mol 1023 /mol
|
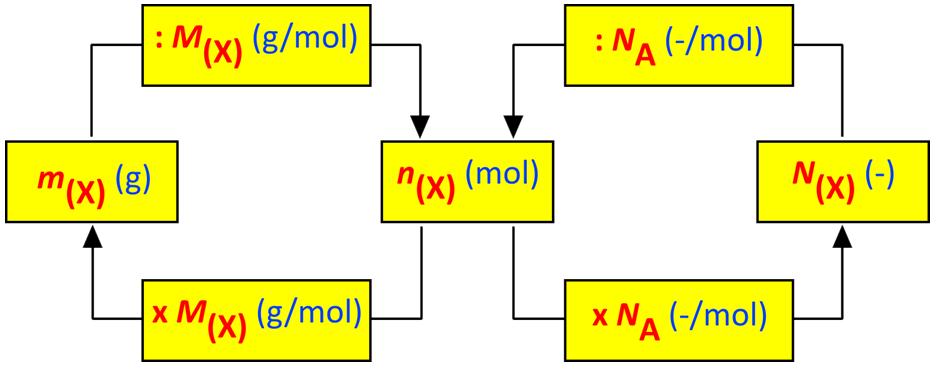
Samengevat
Stofhoeveelheid |
Het omrekenen van gram naar mol en naar het aantal deeltjes is uiteraard zeer belangrijk.
 |
|