|


5. Mol
Atomen, moleculen en ionen zijn enorm kleine deeltjes.
Leggen we 125 000 000 waterstofatomen op een rijtje, mooi tegen elkaar, dan is dat rijtje amper een centimeter lang.
Hoe weinig we van een stof ook nemen, toch hebben we altijd een fantastisch groot aantal deeltjes (atomen, moleculen, ionen).
In één druppel water zijn 2 000 000 000 000 000 000 000 (2 1021) watermoleculen aanwezig.
Het tellen van die moleculen is onbegonnen werk. In de veronderstelling dat je begint te tellen bij je geboorte, dat je per seconde 10 moleculen telt (een hels tempo), dat je doorgaat tot je honderd jaar wordt (en nog steeds in staat om te tellen!), dan nog heb je maar een kleine fractie van die moleculen kunnen tellen. Als heel de wereldbevolking (ongeveer 7 miljard mensen) je meehelpt, 100 jaar lang, dan is er nog maar één tiende van het telwerk gebeurd! 1021) watermoleculen aanwezig.
Het tellen van die moleculen is onbegonnen werk. In de veronderstelling dat je begint te tellen bij je geboorte, dat je per seconde 10 moleculen telt (een hels tempo), dat je doorgaat tot je honderd jaar wordt (en nog steeds in staat om te tellen!), dan nog heb je maar een kleine fractie van die moleculen kunnen tellen. Als heel de wereldbevolking (ongeveer 7 miljard mensen) je meehelpt, 100 jaar lang, dan is er nog maar één tiende van het telwerk gebeurd!
Mol
Als we een chemische reactie uitvoeren, dan voegen we dus steeds een zeer groot aantal deeltjes samen. Om dit aantal deeltjes uit te drukken heeft men de mol ingevoerd.
De mol is de hoeveelheid stof van een systeem dat evenveel deeltjes bevat als er 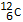 -atomen zijn in 12,0 gram -atomen zijn in 12,0 gram
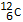 -atomen.
De deeltjes kunnen onder andere atomen, moleculen, ionen of formule-eenheden zijn. -atomen.
De deeltjes kunnen onder andere atomen, moleculen, ionen of formule-eenheden zijn.
Het aantal 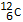 -atomen, aanwezig in één mol, kunnen we als volgt berekenen: -atomen, aanwezig in één mol, kunnen we als volgt berekenen:
massa van een 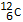 -atoom: 1,0 u = 1,66 -atoom: 1,0 u = 1,66 10−27 kg = 1,66 10−27 kg = 1,66 10−24 g 10−24 g
Het aantal 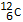 -atomen in 12,0 gram -atomen in 12,0 gram 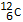 bedraagt dan: bedraagt dan: |
|
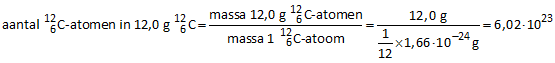

|
Gelijke hoeveelheden, namelijk 1 mol, van verschillende stoffen.
In wijzerzin: 55,9 g ijzermetaal (nagels), 18,0 g water, 180,0 g suiker, 159,6 g kopersulfaat, 200,6 g kwikmetaal,
63,6 g kopermetaal en, in het midden, 32,1 g zwavelbloem.
|
Samengevat
Mol |
1 mol is een hoeveelheid stof die 6,02.1023 deeltjes (atomen, moleculen, ionen, formule-eenheden) bevat.. |
|