De oxidatie en de reductie zijn samen met een groeiend inzicht in de chemische binding geŽvolueerd.
Een oxidatie noemde men oorspronkelijk het binden van zuurstofatomen, later ook het onttrekken van waterstofatomen, een reductie het onttrekken van zuurstofatomen, later ook het binden van waterstofatomen.
Later rangschikte men bij de oxidaties ook reacties, waarin de rol van zuurstof door allerlei niet-metalen zoals chloor en zwavel werd overgenomen. Bij de reducties kwamen reacties waarin de rol van waterstof door koolstof en metalen zoals aluminium werd overgenomen.
Stilaan begon men oxidatie als het afgeven van elektronen en reductie als het opnemen van elektronen te aanzien.
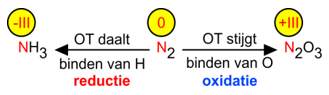
Bovenstaand overzicht laat het verband zien tussen OG-veranderingen en oxidatie en reductie in de oorspronkelijke betekenis.
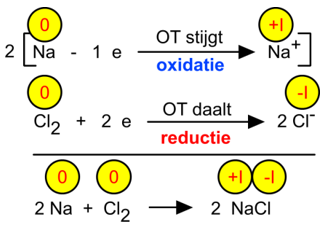
Het reactieverloop van de vorming van NaCl uit natriummetaal en chloorgas, toont duidelijk het verband aan tussen OG-veranderingen en elektronenuitwisselingen.
Vermits geen vrije elektronen kunnen voorkomen moeten de elektronen die vrijkomen bij de oxidatiedeelreactie integraal verdwijnen in de reductiedeelreactie. Dit geeft ons de mogelijkheid om redoxreacties van coŽfficiŽnten te voorzien.