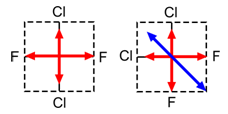
Moleculen van het type AB2
BeCl2 , CO2 , H2O
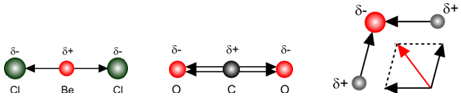
Bij de watermolecule zien we duidelijk dat de vectorsom verschillend is van nul. De watermolecule is dus een dipoolmolecule.
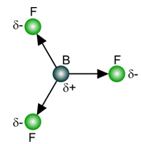
Moleculen van het type AB3
BF3 , NH3
Bij BF3 is het duidelijk te merken dat de som van de vectoren gelijk is aan nul. Het is een apolaire molecule.
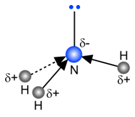
Ook bij NH3 is het tekenen van de vectoren niet echt nodig om te zien dat de som verschillend is van nul. De ammoniakmolecule is dus een dipoolmolecule.
Moleculen van het type AB4
CCl4 , CH4 , CCl2F2
Tekenen we de ruimtelijke voorstelling van de tetraëders, zoals het eigenlijk hoort, dan kunnen we ons via deze perspectieftekening geen som van vectoren voorstellen en wordt het moeilijk om het juiste besluit te trekken. Daarom gaan we de vier bindingen in één vlak afbeelden.
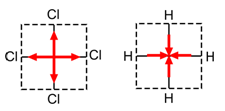
CCl4 en CH4
Het is duidelijk dat in beide gevallen de som van deze vier vectoren gelijk is aan nul: CCl4 en CH4 zijn apolaire moleculen.
In het geval van CCl2F2 moeten we alle mogelijkheden, waarop Cl en F t.o.v. elkaar op het vierkant kunnen geplaatst worden, onderzoeken. Blijkt dat bij één van die gevallen de som der vectoren verschillend is van nul, dan hebben we een dipoolmolecule.