

1. Atoommassa
De SI-eenheid van massa is het kilogram (kg).
De massa-eenheid die we voor atomen gebruiken is u (unit).
| m(H) = 1,0 u |
m(O) = 16,0 u |
m(C) = 12,0 u |
De u is een gekozen atoommassa-eenheid.
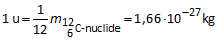
In de praktijk worden vooral relatieve atoommassa’s gebruikt.
Zo is de relatieve atoommassa van koolstof:
Ar(C) = 12,0 u / 1 u = 12,0
Voor berekeningen ronden we de atoommassa’s meestal eerst af tot op 1 decimaal.
Voorbeelden
| Atoomsoort |
Absolute atoommassa m |
Relatieve atoommassa Ar |
| H |
1,0 u |
1,0 |
| O |
16,0 u |
16,0 |
| S |
32,1 u |
32,1 |
Samengevat
Atoommassa |
De atoommassa van een element kan teruggevonden worden in het PS. |
Het is de gemiddelde waarde van de massa's van de verschillende isotope nucliden van dat element, rekening houdend met het procentuele voorkomen in de natuur. |
|