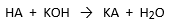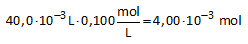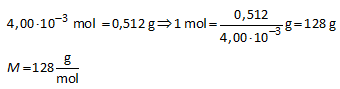0,512 g van een onbekend monoprotisch zuur HA wordt opgelost in genoeg water om 35,0 mL oplossing te bekomen.
De oplossing wordt getitreerd met 0,100 mol/L KOH.
Er is 40,0 mL nodig om het stoichiometrisch punt te bereiken.
Bereken de molaire massa van HA.
| A |
|
|
| B |
|
|
| C |
|
|
| D |
|