Hoeveel mmol HCl moet men toevoegen aan 100 mL 0,10 mol/L methylamine (CH3NH2 / Kb =4,4.10-4) om een buffer met pH 10,0 te bereiden?
Welke reactie heeft plaats als we HCl toevoegen aan methylamine?
Stel die reactie voor in een tabel met daarin de hoeveelheden van de componenten (vóór en na de reactie).
Welke deeltjes zijn er na de reactie aanwezig?
Wat kan je opmerken i.v.m. het Cl-–ion?
Het Cl--ion is de geconjugeerde base van het sterke zuur HCl en is dus een zwakker zuur dan water.
Het mag verwaarloosd worden.
Wat kan je opmerken i.v.m. de andere twee deeltjes?
CH3NH2 en CH3NH3+ vormen een buffer.
Bereken x als we veronderstellen dat we een buffer met pH = 10,0 verkrijgen.
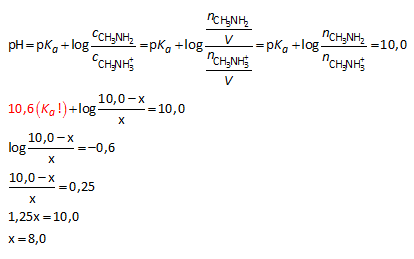
We moeten dus 8,0 mmol HCl toevoegen.
