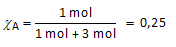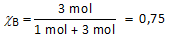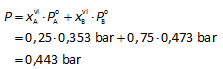Een oplossing bevat 1 mol vloeistof A en 3 mol vloeistof B.
De oplossing heeft bij 25°C een dampdruk van 0,419 bar.
Dampdruk van zuivere vloeistof A bij 25°C = 0,353 bar
Dampdruk van zuivere vloeistof B bij 25°C = 0,473 bar
Welke bewering is juist?
| A |
|
|
| B |
|
|
| C |
|
|
| D |
|