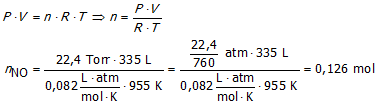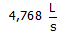![]()
Gasvormig ammoniak kan worden geïnjecteerd in de uitlaatstroom van een fabriek waar kolen worden verbrand om de vervuilende stof NO te reduceren tot N2 volgens:
4 NH3(g) + 4 NO(g) + O2(g)  4 N2(g) + 6 H2O(g)
4 N2(g) + 6 H2O(g)
Neem aan dat de rookgassen van de fabriek een debiet hebben van 335 L.s−1 bij een temperatuur van 955 K
en dat de partieeldruk van NO in de gassen gelijk is aan 22,4 Torr.
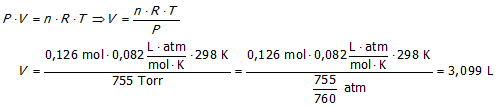
Aan welke snelheid (L.s−1) moet ammoniak worden aangevoerd bij 755 Torr en 298 K om volledig te reageren met NO
wanneer dit ammoniak voor 65 % zuiver is (in volumes gerekend).