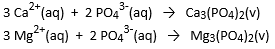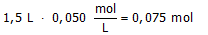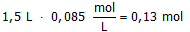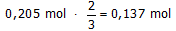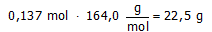![]()
Hard water bevat opgeloste Ca2+- en Mg2+-ionen.
Eén manier om dit water te ontharden is door het toevoegen van fosfaten.
Het fosfaatanion vormt onoplosbare neerslagen met calcium- en magnesiumionen waardoor deze uit de oplossing verwijderd worden.
Neem aan dat een oplossing 0,050 mol.L-1 calciumchloride bevat en 0,085 mol.L-1 magnesiumnitraat.
Welke massa natriumfosfaat moet dan worden toegevoegd aan 1,5 L van deze oplossing
om alle ionen, verantwoordelijk voor de hardheid, te verwijderen?
Ga er van uit dat de reacties volledig aflopend zijn.