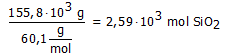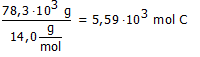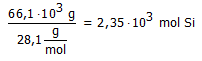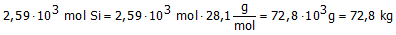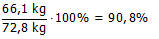Veel computerchips worden gemaakt uitgaande van silicium, dat in de natuur voorkomt onder de vorm van SiO2.
Wanneer siliciumoxide wordt opgewarmd tot het smeltpunt in de aanwezigheid van vast koolstof dan reageert het met vorming van vloeibaar silicium en koolstofmonoxide gas.
Bij de industriële bereiding van silicium reageerde 155,8 kg SiO2 met 78,3 kg koolstof met vorming van 66,1 kg Si.
Bepaal het beperkend reagens, de theoretische en de procentuele opbrengst van de reactie.
Schrijf eerst de reactievergelijking.
Hoeveel mol is 155,8 kg SiO2?
Hoeveel mol is 78,3 kg C?
Hoeveel mol is 66,1 kg Si??
Hoeveel mol N2F4 kan er theoretisch bekomen worden?
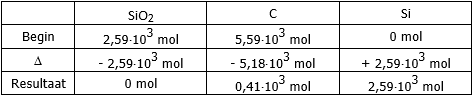
De theoretische opbrengst kan je best bepalen uit een tabel waarin een overzicht gegeven wordt van
de hoeveelheden die aanwezig zijn vóór de reactie,
de hoeveelheden die verdwijnen en ontstaan en de hoeveelheden na de reactie.
Wat is het beperkend reagens?
Wat is de theoretische opbrengst?
Hoe groot is het rendement van de reactie?

![]()