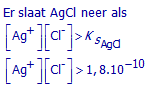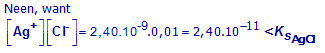![]()
Een 0.01 mol/L oplossing van AgNO3 wordt 0.50 mol/L gebracht aan NH3 (dit wil zeggen dat er NH3 wordt toegevoegd tot de concentratie ervan 0,50 mol/L bedraagt), waarbij zich een Ag(NH3)2+-complex vormt.
Zal AgCl neerslaan als voldoende vast NaCl toegevoegd wordt om de oplossing 0.01 mol/L aan Cl- te maken?
Ks(AgCl) = 1,8.10-10
Kinst(Ag(NH3)2+) = 6,0.10-8