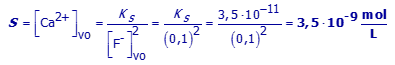![]()
Bereken de oplosbaarheid S (in mol/L) van CaF2
a. in zuiver water
b. in een Ca(NO3)2-oplossing 0,1 mol/L
c. in een KF-oplossing 0,1 mol/L
Ks (CaF2) = 3,5.10-11
(a) Telkens er één CaF2–deeltje oplost, ontstaat er één Ca2+–ion in de oplossing. Druk S uit in functie van [Ca2+]vo.
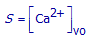
(a) Telkens er één CaF2–deeltje oplost, ontstaan er twee F-–ionen in de oplossing. Druk S uit in functie van [F-]vo.
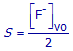
(a) Gebruik bovenstaande uitdrukkingen en de uitdrukking voor Ks om de oplosbaarheid in zuiver water te berekenen.

(b) Telkens er één CaF2–deeltje oplost, ontstaat er wel één Ca2+–ion in de oplossing, maar er waren in het begin al Ca2+–ionen in de oplossing aanwezig. De oplosbaarheid S kan in dit geval dus enkel berekend worden uit [F-]vo. Druk S uit in functie van [F-]vo.
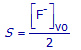
(b) Gebruik bovenstaande uitdrukking en de uitdrukking voor Ks om de oplosbaarheid in aanwezigheid van Ca2+ te berekenen.
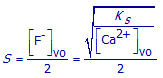
(b) Voor het berekenen van [Ca2+] moeten we rekening houden met het feit dat er in deze verzadigde oplossing twee soorten Ca2+–ionen aanwezig zijn:
-
de Ca2+–ionen die in het begin al aanwezig waren in de oplossing: co = 0,1 mol/L,
-
de Ca2+–ionen die extra in de oplossing verschijnen door het oplossen van CaF2 : evenveel als er CaF2 -deeltjes oplossen, dus met concentratie S.
De totale concentratie van de Ca2+-ionen is de som van beide.
Vervang in bovenstaande betrekking de concentratie van de Ca2+-ionen door deze uitdrukking.
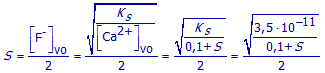
(b) De oplosbaarheid van CaF2 in water is zeer klein (zie stap 3: 2,1.10-4 mol/L). Door de aanwezigheid van een gemeenschappelijk ion is de oplosbaarheid nog veel kleiner en te verwaarlozen naast de beginconcentratie van de Ca2+-ionen . Los bovenstaande vereenvoudigde vergelijking op en je vindt de oplosbaarheid in dit geval.

(c) Telkens er één CaF2-deeltje oplost, ontstaan er wel twee F-–ionen in de oplossing, maar er waren in het begin al F-–ionen in de oplossing aanwezig. De oplosbaarheid S kan in dit geval dus enkel berekend worden uit [Ca2+]vo. Druk S uit in functie van [Ca2+]vo.
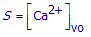
(c) Gebruik bovenstaande uitdrukking en de uitdrukking voor Ks om de oplosbaarheid in aanwezigheid van F- te berekenen.

(c) Voor het berekenen van [F-] moeten we rekening houden met het feit dat er in deze verzadigde oplossing twee soorten F--ionen aanwezig zijn:
-
de F- -ionen die in het begin al aanwezig waren in de oplossing: co = 0,1 mol/L,
-
de F- -ionen die extra in de oplossing verschijnen door het oplossen van CaF2 : dubbel zoveelals er CaF2 -deeltjes oplossen, dus met concentratie 2S.
De totale concentratie van de F--ionen is de som van beide.
Vervang in bovenstaande betrekking de concentratie van de F--ionen door deze uitdrukking.

(c) De oplosbaarheid van CaF2 in water is zeer klein (zie stap 3: 2,1.10-4 mol/L). Door de aanwezigheid van een gemeenschappelijk ion is de oplosbaarheid nog veel kleiner en te verwaarlozen naast de beginconcentratie van de F--ionen . Los bovenstaande vereenvoudigde vergelijking op en je vindt de oplosbaarheid in dit geval.