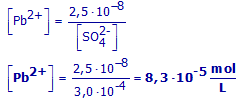![]()
Een oplossing is 0,15 mol/L aan Pb2+-ionen en 0,20 mol/L aan Ag+-ionen.
Aan deze oplossing wordt Na2SO4(v) toegevoegd waarbij mag verondersteld worden dat het volume constant blijft.
a. Welk neerslag wordt eerst gevormd?
b. Nadien wordt verder Na2SO4 toegevoegd tot het tweede kation neerslaat.
Wat is op dat ogenblik de concentratie van het eerste kation in de oplossing?
Ks (PbSO4) = 2,5.10-8
Ks(Ag2SO4) = 1,2.10-5