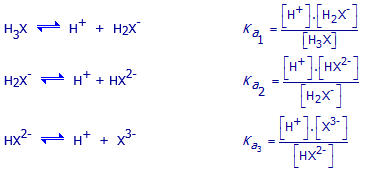Ethyleendiamine-N,N’-diazijnzuur
kan gebruikt worden als additief in waspoeders. In de meest zure vorm kan
het product beschouwd worden als een zwak triprotisch zuur (H3X).
In de handel is het product verkrijgbaar in de amfolytvorm Na2HX.
25,00 mL van een stockoplossing van Na2HX wordt getitreerd
met 0,400 mol/L HCl(aq).
Bij het beginpunt van de titratie bedraagt de pH van de oplossing 8,20.
Het SP1 wordt bereikt na toevoegen van 6,00 mL HCl; het SP2 wordt bereikt bij 12,00 mL.
Na 4,00 mL HCl te hebben toegevoegd, bedraagt de pH 6,42 en na 8,00 mL HCl
bedraagt de pH 3,40.
a. Bereken de concentratie aan Na2HX in de stockoplossing.
b. Bereken pKa1 , pKa2 en pKa3 van H3X.
c. Bereken de pH bij SP2.
d. Wat is de pH van een 0,10 mol/L Na3X-oplossing?
In de meest zure vorm kan het product beschouwd worden als een zwak
triprotisch zuur (H3X) dat dus maximaal drie waterstofionen (protonen) kan
afsplitsen. Schrijf de 3 ionisatie-evenwichten met de uitdrukkingen voor
de drie zuurconstanten.
a. Bereken de concentratie van het Na2HX in de stockoplossing.
25,00 mL van een
stockoplossing van Na2HX wordt getitreerd met 0,400 mol/L HCl(aq).
Het SP1 wordt bereikt na toevoegen van 6,00 mL HCl.
Bereken hieruit de concentratie van Na2HX.
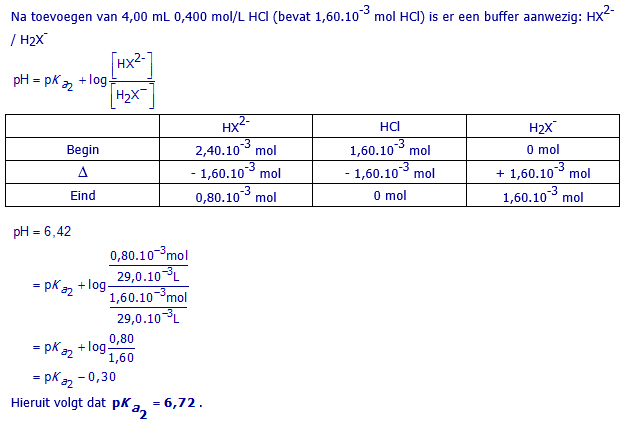
b. Bereken pKa2 van H3X
25,00 mL van een stockoplossing van Na2HX wordt getitreerd met 0,400 mol/L HCl(aq). Na 4,00 mL HCl te hebben toegevoegd, bedraagt de pH 6,42.
Bereken hieruit pKa2.
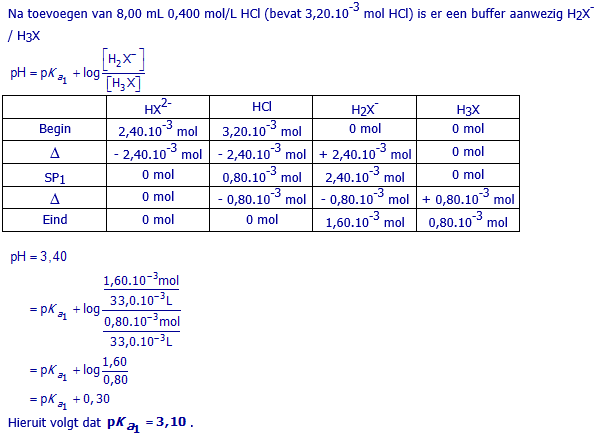
b. Bereken pKa1 van H3X
25,00 mL van een stockoplossing
van Na2HX wordt getitreerd met 0,400 mol/L HCl(aq).
Na 8,00 mL HCl te hebben toegevoegd, bedraagt de pH 3,40.
Bereken uit deze gegevens pKa1.
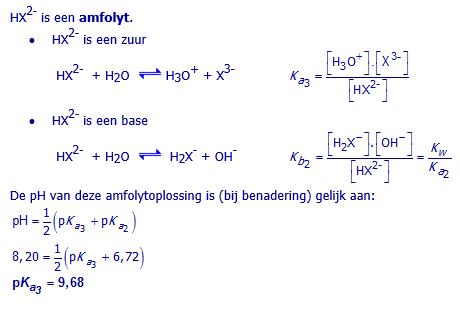
b. Bereken pKa3 van H3X
25,00 mL van een
stockoplossing van Na2HX wordt getitreerd met 0,400 mol/L HCl(aq).
Bij het beginpunt van de titratie bedraagt de pH van de oplossing 8,20.
Bereken uit deze gegevens pKa3.
c. Bereken pH bij SP2
25,00 mL van een
stockoplossing van Na2HX wordt getitreerd met 0,400 mol/L HCl(aq).
Het SP2 wordt bereikt bij 12,00 mL.
Bereken hieruit de pH bij SP2.
d. Wat is de pH van een 0,10 mol/L Na3X-oplossing
Na3X is een zwakke
base. Voor de pH-berekening moet je alleen rekening houden met de eerste
hydrolysereactie (bij de andere ligt het evenwicht nog meer links).
Bereken de pH van deze oplossing.