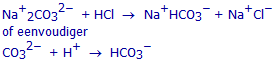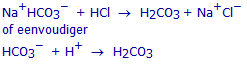Een oplossing bevat zowel Na2CO3 als NaHCO3. De pH van deze oplossing bedraagt 10,22.
Bij titratie van 25,0 mL van deze oplossing met een 0,100 mol/L HCl-oplossing wordt een eerste stoichiometrisch punt bereikt
na toevoegen van 8,00 mL.
Na hoeveel mL wordt het tweede stoichiometrisch punt bereikt?
Wat (zuur, base, sterk, zwak, buffer, amfolyt) is Na2CO3?
Wat (zuur, base, sterk, zwak, buffer, amfolyt) is NaHCO3?
Wat (zuur, base, sterk, zwak, buffer, amfolyt) is in de oorspronkelijke oplossing aanwezig?
Bereken uit de pH van deze buffer de verhouding van de concentraties Na2CO3/NaHCO3.
Welke reactie zal plaatsvinden bij toevoegen van HCl?
Hoeveel mol HCl moeten we toevoegen om het stoichiometrisch punt van deze reactie te bereiken?
Hoeveel mol Na2CO3 bevat de oorspronkelijke oplossing?
Bereken nu hoeveel mol NaHCO3 de oorspronkelijke oplossing bevat. (zie punt 4)
Bereken nu hoeveel mol NaHCO3 de oplossing bevat als de eerste reactie afgelopen is. (Som van: oorspronkelijk aanwezig + gevormd tijdens reactie 1)
Welke reactie heeft plaats als we nu nog meer HCl toevoegen?
Hoeveel mol HCl moeten we toevoegen om het stoichiometrisch punt van deze tweede reactie te bereiken?
Hoeveel mL 0,100 mol/L HCl-oplossing is dit?
Hoeveel mL 0,100 mol/L HCl moeten we dus in het totaal toevoegen om het tweede stoichiometrisch punt te bereiken?
8,0 mL + 18,3 mL = 26,3 mL

|
![]()