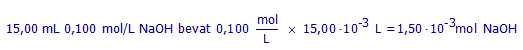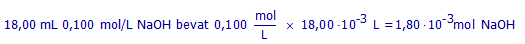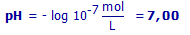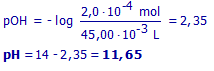25,00 mL van een oplossing die 0,032 mol/L is aan HNO3 en 0,040 mol/L aan HCl wordt getitreerd met een 0,100 mol/L NaOH-oplossing.
a. Hoeveel stoichiometrische punten worden zichtbaar en na hoeveel mL?
b. Wat is de pH van de titratie-oplossing nadat 15,00 mL , 18,00 mL en 20,00 mL NaOH-oplossing toegevoegd werd?
(a) Wat (zuur, base, sterk, zwak, buffer, amfolyt) zijn HNO3 en HCl en wat is er dus aanwezig bij het begin van de titratie?
(a) Wat (zuur, base, sterk, zwak, buffer, amfolyt) is NaOH?
(a) Welke reactie gebeurt er bij het toevoegen van NaOH?
(a) Hoeveel stoichiometrische punten zullen er zichtbaar worden?
Er zal dus slechts één stoichiometrisch punt zichtbaar zijn.
(a) Na hoeveel mL toegevoegd NaOH hebben beide sterke zuren gereageerd?
(b1) Hoeveel mol NaOH bevat 15,00 mL NaOH-oplossing 0,100 mol/L?
(b1) Hoeveel mol sterk zuur blijft er na de reactie nog over?
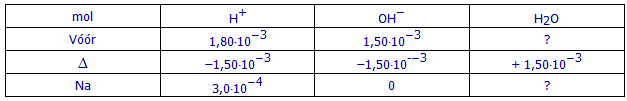
3,0.10-4 mol
(b2) Hoeveel mol NaOH bevat 18,00 mL NaOH-oplossing 0,100 mol/L?
(b2) Hoeveel mol sterk zuur blijft er na de reactie nog over?
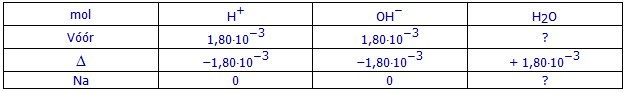
0 mol
(b3) Hoeveel mol NaOH bevat 20,00 mL NaOH-oplossing 0,100 mol/L?
(b3) Hoeveel mol sterke base is er na de reactie aanwezig?
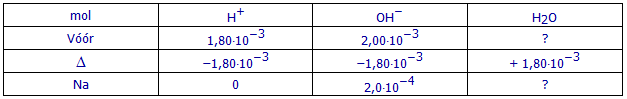
2,0.10-4 mol

|
![]()