![]()
Voor de reactie 2 NO(g) + Cl2(g) ⇌ 2 NOCl(g) is Kc = 4,6.104 (mol-1.L).
Schrijf de betrekking op om de evenwichtsconcentraties te berekenen, vertrekkende van
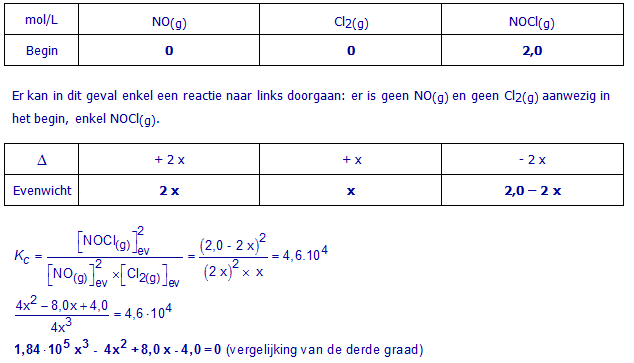
a. 2,0 mol zuiver NOCl(g) in een vat van 1,00 L
Schrijf eerst de uitdrukking voor Kc.
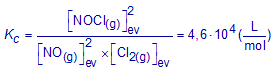
Maak een overzichtstabel voor dit evenwicht (Begin , Δ , Evenwicht). Schrijf in die tabel meteen concentraties (mol/L). Gebruik x als onbekende.
Vervang de evenwichtsconcentraties in de formule voor Kc door de evenwichtsconcentraties uit de tabel. Werk uit en schrijf de vergelijking waaruit x kan berekend worden. Het oplossen van deze vergelijking is niet nodig.
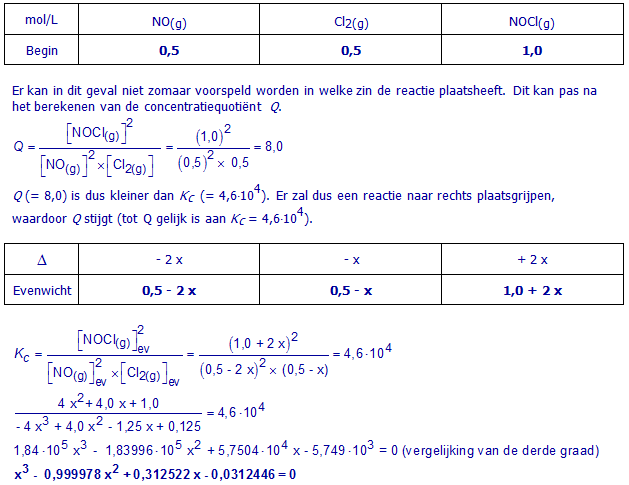
b. 4,0 mol NO(g) en 2,0 mol Cl2(g) in een vat van 0,50 L
Maak een overzichtstabel voor dit evenwicht (Begin , Δ , Evenwicht). Schrijf in die tabel meteen concentraties (mol/L). Gebruik x als onbekende.
Vervang de evenwichtsconcentraties in de formule voor Kc door de evenwichtsconcentraties uit de tabel. Werk uit en schrijf de vergelijking waaruit x kan berekend worden. Het oplossen van deze vergelijking is niet nodig.

c. 2,0 mol/L NO(g) en 2,0 mol/L NOCl(g)
Maak een overzichtstabel voor dit evenwicht (Begin , Δ , Evenwicht). Schrijf in die tabel meteen concentraties (mol/L). Gebruik x als onbekende.
Vervang de evenwichtsconcentraties in de formule voor Kc door de evenwichtsconcentraties uit de tabel. Werk uit en schrijf de vergelijking waaruit x kan berekend worden. Het oplossen van deze vergelijking is niet nodig.

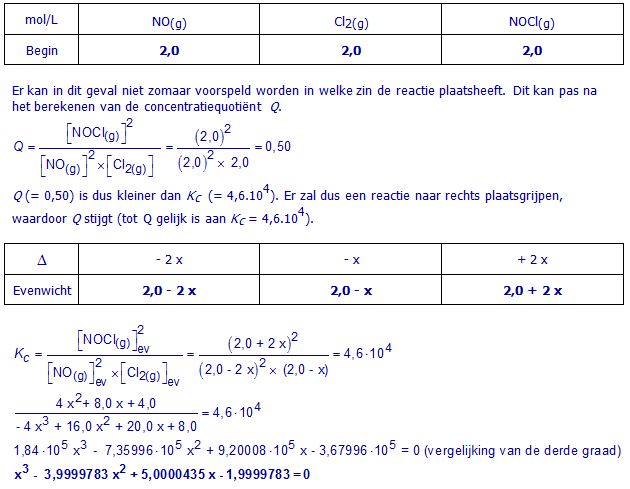
d. 2,0 mol/L NO(g) , 2,0 mol/L Cl2(g) en 2,0 mol/L NOCl(g)
Maak een overzichtstabel voor dit evenwicht (Begin , Δ , Evenwicht). Schrijf in die tabel meteen concentraties (mol/L). Gebruik x als onbekende.
Vervang de evenwichtsconcentraties in de formule voor Kc door de evenwichtsconcentraties uit de tabel. Werk uit en schrijf de vergelijking waaruit x kan berekend worden. Het oplossen van deze vergelijking is niet nodig.
e. 1,0 mol NO(g) , 1,0 mol Cl2(g) en 2,0 mol NOCl(g) in een vat van 2,0 L
Maak een overzichtstabel voor dit evenwicht (Begin , Δ , Evenwicht). Schrijf in die tabel meteen concentraties (mol/L). Gebruik x als onbekende.
Vervang de evenwichtsconcentraties in de formule voor Kc door de evenwichtsconcentraties uit de tabel. Werk uit en schrijf de vergelijking waaruit x kan berekend worden. Het oplossen van deze vergelijking is niet nodig.