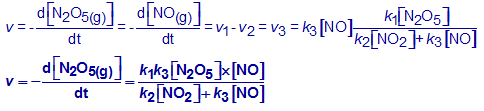![]()

De snelheid van bovenstaande reactie kan op verschillende manieren uitgedrukt worden:
• de snelheid waarmee N2O5(g) verdwijnt,
• de snelheid waarmee NO(g) verdwijnt.
Giet dit in een wiskundige formule.
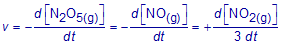
Volgens het voorgestelde reactiemechanisme verdwijnt er N2O5(g) in deelreactie 1 met een snelheid v1 , terwijl er N2O5(g) ontstaat in deelreactie 2 (die overigens de omgekeerde reactie is) met een snelheid v2.
Schrijf de globale snelheid v in functie van v1 en v2.
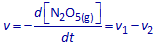
Volgens het voorgestelde reactiemechanisme verdwijnt er NO(g) in deelreactie 3 (en enkel daar!) met een snelheid v3.
Schrijf de globale snelheid v in functie van v3.
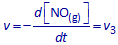
De globale snelheid v uit stappen 2 en 3 is natuurlijk dezelfde. Schrijf nu het verband tussen v1 , v2 en v3 dat volgt uit die vaststelling.
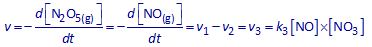
Volgens de gegevens wordt NO3(g) even snel gevormd in deelreactie 1 als het verdwijnt in deelreacties 2 en 3.
Schrijf nu het verband tussen v1 , v2 en v3 dat volgt uit deze vaststelling.
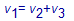
Vervang in bovenstaande uitdrukking (Stap 5) de drie snelheden door toepassen van de reactiesnelheidsvergelijking voor de drie deelreacties.
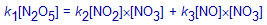
Bereken met behulp van bovenstaande uitdrukking (Stap 6) de concentratie van NO3(g).
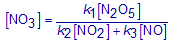
De derde reactie is de snelheidsbepalende stap: dit betekent dat de globale snelheid gelijk is aan de snelheid van deze deelreactie.
Pas de reactiesnelheidsvergelijking toe op deze derde stap en vervang in die uitdrukking de concentratie van NO3 door de waarde uit Stap 7.
Wat vind je dan voor de globale reactiesnelheid?